
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Небелковые азотсодержащие веществаНебелковые азотсодержащие вещества пищевых продуктов представлены аминокислотами, аммиаком и его производными, пуриновыми азотистыми основаниями, амидами кислот, нитритами, нитратами, алкалоидами. Многие из них являются промежуточными или конечными продуктами белкового обмена растительных и животных организмов и имеют важное биологическое значение. Небелковые азотсодержащие вещества участвуют в образовании специфического вкуса и аромата продуктов. При варке продуктов они переходят в бульон и, видоизменяясь, сообщают ему аромат и вкус. Некоторые из них стимулируют деятельность пищеварительных желез. Из общего содержания азотсодержащих веществ на долю небелковых азотсодержащих соединений приходится 6,5—10 % в мясе животных, 8—38 % — в рыбе, 1,7—30 % —в плодах и овощах. Количество их в продуктах зависит также от степени ферментативного и неферментативного гидролиза белков, происходящего во время переработки и хранения товаров. Свободные аминокислоты находятся в растительных и животных тканях в малых количествах: в свежем мясе — 100-720 мг%, в водорослях — 150—270 мг%. При хранении продуктов их количество увеличивается. Так, в свежеубном картофеле содержится аминокислота тирозин —5-10 мг%. а после семи месяцев хранения — до 40—45 мг%. Амиак и его органические производные, в частности амины, находятся в продуктах в незначительйых количестве. Повышенное их содержание свидетельствует о гнилостном распаде белков. Например, в живой рыбе имеется 3—9 мг% аммиака, во время хранения его количество возрастает. М е т и л а м и н ы накапливаются в мясе и рыбе в результате разложения липопротеидов и придают продуктам неприятный запах. При гниении белков образуются и ядовитые для человека амины — к а д а в е р и н (из аминокислоты лизина), п у т р е с ц и н (из орнитина), г и с т а м и н (из гис-  тидина). Пуриновые азотистые основания содержатся во многих вкусовых товарах. К ним относятся д и м е т и л к с а н т и н , известный под названием т е о б р о м и н (в какао, шоколаде), и т р и м е т и л к с а н т и н , или к о ф е и н (в кофе, чае). Пиридин и его производные входят в состав витаминов В, РР и др., вкусовых продуктов (перец, табак), ДНК, РНК: Амиды кислот являются производными жирных кислот, распространены в животных и растительных продуктах. Из амидов кислот аспарагин в большом количестве находится в спарже, капусте (до 0,32 % ) , г л у т а м и н — в свекле (0.5 % ) , горохе, сладком перце и др. Эти амиды образуются в растительных и животных организмах в результате связывания аспарагиновой и глутаминовой кислот с NНз, образующимся в процессе обмена веществ. Амид мочевины (амид угольной кислоты): содержится в мясе акул и скатов (2000—2750 мг%) и придает ему неприятный запах. Нитриты (NaNO2) добавляют в мясо при производстве колбасных изделий, мясных копченостей, солонины для сохранения розово-красной окраски готовых продуктов. Санитарным законодательством Республики Беларусь установлена предельно допустимая норма содержания нитритов, поскольку они оказывают вредное влияние на организм человека. При повышенном их содержании в продуктах образуются н и т р о з а м и н ы (взаимодействие нитритов с вторичными аминами в присутствии водорода):
Нитрозамины очень опасны, так как обладают токсическим и канцерогенным действием. Нитраты находятся в некоторых растительных продуктах: крапиве (до 5 % КМОз в переводе на сухое вещество), тыкве, кабачках и др. Влияние нитратов на организм человека зависит от дозы, длительности поступления в организм, возраста человека и т.д. Перечень болезней, вызываемых нитратами, весьма обширен — от нитратного отравления до хронического действия на иммунную, нервную и сердечно-сосудистую системы. Предельно допустимая доза нитратов для человека не должна превышать 5 мг на 1 кг массы тела. В организме человека под влиянием кишечной микроф лоры происходит восстановление нитратов в нитриты, которые всасываются в кровь и блокируют центры дыхания. Кроме того, при продолжительном хранении овощей, особенно с высоким исходным содержанием нитратов, некоторая
55. Строение и свойства ферментов — это вещества белковой природы, катализирующие процессы распада и синтеза в животных и растительных организмах. Они играют огромную роль в процессах питания и обмена веществ. Не меньшее значение имеют ферменты в процессах хранения и производства пищевых продуктов. По характеру своего действия ферменты относятся к биокатализаторам и вырабатываются только в клетках животных, растений и микроорганизмов, но проявляют свое действие не только в клетках, но и будучи выделенными из них. В настоящее время из биологических объектов выделено около 3500 и изучено несколько сотен ферментов. Полагают, что живая клетка может содержать более1000 различных ферментов. Каждый фермент, как правило, катализирует только один тип химической реакции. При этом катализируемые в организме ферментативные реакции не сопровождаются образованием побочных продуктов, в то время как в органических реакциях, проводимых с помощью искусственных катализаторов, всегда образуется хотя бы один или несколько таких продуктов. Ферменты делятся на однокомпонентные, являющиеся простыми белками, и двухкомпонентные, в которых белок соединен с небелковой частью, называемой коферментом. В состав ферментов входят витамины B1, В2, В3, В6, РР и др., нуклеотиды, атомы железа, меди и др. К однокомпонентным ферментам относятся у р е а з а семян сои, амилаза солода и др., к двухкомпонентным — карбоксилаза, каталаз а и др. Будучи белковыми веществами, ферменты находятся в коллоидном состоянии, при нагревании и добавлении солей тяжелых металлов инактивируются, являются амфотерными электролитами, высаливаются при добавлении к их растворам нейтральных солей. Для ферментов характерна специфичность действии, высокая каталитическая активность. Специфичность действия заключается в том, что каждый фермент действует на вещество определенного структурного характера, например фермент сахараза катализирует только сахарозу. Каталитическая активность ферментов огромна и во много раз превышает активность неорганических катализаторов. Так, для расщепления белков до аминокислот с помощью 25 % серной кислоты при кипячении необходим 20 часов, а под действием фермента трипсина в организме человека этот процесс проходит за 2—3 часа. Ферменты сохраняют аЯ тивность при больших разведениях. Так, пероксидаза действует при разведении 1:5 ООО ООО.
56. Факторы, влияющие на деятельность ферментов. На активность ферментов влияют температура, рН среды, влажность и присутствие некоторых химических веществ. Для каждого фермента существует оптимальная температура. Для большинства из них благоприятной температурой является 30—50 °С. При нагревании свыше 80 °С ферменты разрушаются, при низких (минусовых) температурах активность их резко понижается. Поэтому скоропортящиеся продукты (мясо, рыба, яйца и др.) хранят в охлажденном и замороженном состоянии. При низких (минусовых) температурах ферменты действуют, если не вся вода продукта превратилась в лед. Например, липаза не теряет активность при -24 °С. После размораживания ее активность значительно выше первоначальной (до замораживания). Очевидно, плохая сохраняемость размороженных продуктов происходит в результате активизации ферментов. Оптимальная величина рН для ферментов разная. Так, для мальтазы она равна 6,5—7,2, липазы — 7—7,5, пепсина который выделяется в сильнокислотную среду желудка, — 1,5 - 2,5. Незначительные сдвиги значения рН замедляют и прекращают действие ферментов. Повышение содержания влаги в продукте до определенного момента усиливиет деятельность фермента, поэтому, например, интен-'ишюсть дыхания влажного зерна выше, чем сухого. На активность ферментов влияет присутствие в растворах некоторых химических веществ. Одни из них повышают активность ферментов и называются активаторами, другие понижают активность и называются ингибиторами-парализаторами. Например, этилен ускоряет, а углекислый газ замедляет ферментативные процессы дозревания яблок, груш. Активаторами ферментов являются ионы метал-Na+, К+, Rb+, Mg2+, Са2+, Cu2+, Fe2+ и соединения, содержащие сульфгидрильные группы SH, а также HCN, H2S. Ингибиторами ферментов являются соли тяжелых металлом, осаждающие ферменты, и вещества, ослабляющие действие ферментов, например окислители Н2О2 и бромат калия, тормозящие действие протеаз. Специфические ингибиторы действуют только на определенные ферменты. Так, синильная кислота действует только на окислительные ферменты, содержащие в актином центре железо или медь. Синильная кислота вступает в соединение с металлами, и фермент теряет активность. Сущность действия ингибиторов в большинстве случаев состоит в том, что они соединяются с активными группами или активными центрами молекулы фермента. Активность ферментов зависит от состояния вещества, на которое они оказывают действие. Так, денатурированные белки быстрее гидролизуются, чем те же белки в коллоидном состоянии; разрушенные крахмальные зерна гидролизуются быстрее, чем целые, и т.д.
Номенклатура ферментов В начальный период развития учения о ферментах им вали названия без определенной системы, по случай признакам, названию субстрата или типу катализируемой реакции. Так, фермент пепсин получил название от греческого слова «пепсис» — перевариваю, папаин — от сока папайи, богатого ферментом. В 1961 г. постоянным комитетом по ферментам при Международном биохимическом союзе была разработана современная номенклатура и классификация ферментов, в соответствии с которой название ферментов составлялось из химического названия субстрата или названия той реакции которая осуществлялась ферментом. К латинскому названию корня субстрата, на который действует фермент, или названию процесса, катализируемого данным ферментом добавлялось окончание «аза» — мальтаза, лактаза. При этом для многих ферментов сохранились старые названия —трипсин, папаин и др.
58. Классификация ферментов. По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов. Классификация была предложена Международным союзом биохимии и молекулярной биологии. Каждый класс содержит подклассы. Оксидоредуктазы.К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Различают следующие основные оксидоредуктазы: аэробные дегидрогеназы, анаэробные дегидрогеназы, каталазу и пероксидазу. Трансферазы.К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидныхостатков, азотистых групп, остатков фосфорной и серной кислот и др. Например: фосфотрансферазы, гликозилтрансферазы и др. Гидролазы.В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат-гидролаза». К ним относятся: эстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; амидазы, ускоряющие разрыв амидных связей, отличных от пептидных, и протеазы др. Лиазы.К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Они играют важную роль в превращении органических веществ. В эту группу входят декарбоксилазы (карбокси-лиазы), углерод-кислород-лигазы и др. Изомеразы - класс ферментов, катализирующих превращение некоторых органических веществ в их изомеры например глюкозофосфорную кислоту во фруктозофосфорную. Ферменты этой группы играют большую роль в обмене ществ, катализируя превращение важных промежуточ продуктов брожения и дыхания. Лигазы - катализируют реакции соединения друг с другом двух молекул органических веществ, присоединение отдельных аминокислот к транспортным РНК ацетильных остатков к коферменту.
59. Характеристикаферментов. Ферменты - это белки-катализаторы химических реакций. Они контролируют почти все метаболические процессы, протекающие в организме, путем связывания суб-стратов - исходных веществ ферментативных реакций - и их химического превращения в продукты реакции. По типу катализируемой реакции ферменты разделяют на 6 классов:
Значение ферментов В основе процессов, происходящих при изготовлении хранении многих пищевых продуктов, лежат ферментатные изменения, вызываемые деятельностью тканевых ферментов или ферментных препаратов и ферментов, выделяемых микроорганизмами. Изучение механизма действия ферментов помогает вы нить процессы, происходящие при посмертном созревая мяса и рыбы, дозревании плодов, изготовлении пива, сок вина, сыров, чая, кофе, табака и т.д. и дает возможность установить сроки и необходимые условия хранения (температуру, влажность, газовый состав среды) продуктов. Например, в клубнях картофеля наблюдается минимальная активность ферментов (естественно, и минимальная интенсивность дыхания) при температуре 4 °С. Более высокая к более низкая температура до определенного предела способствует активизации ферментов. Поэтому оптимальной для хранения картофеля в зимний период является температура 4 °С. Ферментативные процессы в яблоках резко замедляются при хранении их в среде с пониженным содержанием O2 —3 %и повышенным количеством С02 (3—5 %) по сравнению с обычной атмосферой. Такая газовая среда рекомендована для увеличения срока хранения этих плодов. Ферментные препараты широко используются в пищевой промышленности для получения аминокислот из небелкового сырья. Протеолитические ферменты применяются в производстве хлеба, при переработке рыбы, для обработки сырной массы; пектазы — при изготовлении плодовых соков и пива; амилазы — в производстве хлеба, пива; протеиназы — для смягчения мяса и т.д.
61. Значение витаминов в питании и связь их с ферментами Витамины представляют собой группу сравнительно низкомолекулярных органических соединений разнообразного химического строения, объединенных по признаку ихстрогой необходимости для питания животного и человеческого организма. По сравнению с основными питательными псществами — белками, жирами и углеводами витамины требуются в ничтожно малых количествах и выполняют в организме те или иные каталитические функции. Основным поставщиком витаминов для человека и животных являются растения, где они синтезируются. Длительное отсутствие в пище того или иного витамина иызывает заболевание, которое носит название «авитамноз». Встречаются заболевания, которые носят название гипервитаминозы. Они связаны с избыточным поступление в организм витаминов. Гипервитаминозы бенно опасны в детском возрасте. Повышенная потребность в витаминах возникает при усиленной физической нагрузке, переохлаждении организма, ряде заболеваний желудочно-кишечного тракта, у женщин во время беременности. В результате длительных исследований было установлено, что существует тесная связь между витаминами и ферментами. Взаимоотношения витаминов и ферментов характеризуются, с одной стороны, тем, что некоторые витамины получаются в результате ферментативных реакций (напри: мер, при ферментативном гидролизе каротина получается витамин А), а с другой — что некоторые витамины рассматриваются в настоящее время как составные части молекулы ферментов. Витамин С также рассматривается как активная группа, участвующая в окислительно-восстановительных процессах. В зависимости от вида продуктов добавление витаминов имеет целью ревитаминизацию, стандартизацию, обогащение, витаминизацию или специальное воздействие при технологической переработке продуктов питания. Ревитаминизация заключается в добавлении витаминов в те продукты питания, которые теряют их при переработке. В качестве примера можно привести добавление водорастворимых витаминов B1, В2 и РР к пшеничной муке и обрушенному рису, а также жирорастворимых витаминов А и D к обезжиренному молоку. Стандартизация и обогащение витаминами применяют при производстве фруктовых соков. При обогащении соков поддерживают заданную концентрацию витамина С и следуют общему принципу — добавлять прежде всего те витамины, которые содержались в продуктах первоначально. Во многих странах в зимние месяцы добавляют витамин А к молоку. Витаминизация витаминами А и D проводится при изготовлении маргарина, поскольку сам маргарин не содержит этих витаминов, но является идеальным их носителем. Два витамина используются для стабилизации продуктов питания. Это витамины С и Е, действующие как антиоксиданты. Они обладают свойством связывать кислород, предотвращая тем самым его разрушающее воздействие на пищевые продукты. Сам антиоксидант при этом разрушается. Свойство растворимости этих витаминов определяет область их применения. Витамин С растворим в воде, витамин Е — в жирах. Поэтому витамин С используется для стабилизации напитков (пива, вина, фруктовых соков), а витамин Е (токоферол) для стабилизации жиров и В целях специального воздействия при технологической переработке продуктов питания витамин С, кроме т применяется для обогащения муки с незначительным содержанием клейковины. В мясоперерабатывающей промышленности витамин С используется для ускорения процесса побурения при посололе, благодаря чему уменьшается добавка NaNО2. Витамин С предохраняет мясо от изменений, вызываемых окислительными процессами, и стабилизирует окраску. Каротиноиды (провитамин А) используются в пищевой промышленности в качестве безвредных красящих веществ. Следует отметить, что все витамины, за исключением B12, получают с помощью химического синтеза.
62. Классификация витаминов Все витамины принято обозначать буквами латинского алфавита, хотя в последнее время витаминам дают более определенные названия, соответствующие их химическому составу или действию в организме. Витамины делят на две группы: водорастворимые и жирорастворимые. К группе водорастворимых относятся С, РР, В1; В2, В6, В12, В15, Н, Р. К группе жирорастворимых —А, D, Е, К.
63. Химическая природа и биологическая роль водорастворимых витаминов С (аскорбиновая кислота) относится к числу наиболее важных витаминов. Отсутствие его приводит к развитию такого тяжелого заболевания, как цинга, недостаток — различных авитаминозов, вызывающих слабость, утомляемость, восприимчивость к инфекционным болезням. Витамин С является катализатором окислительно-восстановительных процессов, протекающих в живых организмах. Аскорбиновая кислота легко восстанавливает различные окисленные формы ферментов, превращаясь при этом в дегидроаскорбиновую кислоту, которая затем восстанавливается глютатином. В организме взрослого человека содержится около 5 г аскорбиновой кислоты. Потребность в витамине С составляет в сутки 100 мг. Прием его свыше 7500 мг вызывает понос, кровотечение из десен, боли. Кроме того, высокие дозы витамина С стимулируют образование камней в почках, приводят к развитию сердечно-сосудистых заболеваний. Большое количество аскорбиновой кислоты находится в свежих плодах и овощах (удовлетворительно сохраняется — и квашеных). Особенно богаты витамином С: капуста — 80 мг%, стручковый перец — 130, лимон— 40, зеленые грецкие орехи — 1800, черная смородина — 400, шиповник — 2500, картофель — 25, смородина красная — 8-16 мг%. При длительном хранении плодов и овощей содержание витамина С в них резко уменьшается, так как он расходуется на дыхание (весной картофель, капуста, яблоки почти не содержат витамин С). Аскорбиновая кислота устойчива в кислых растворах и при этом выдерживает кипячение. При варке, сушке плодов и овощей она легко разрушается. В1 (тиамин, аневрин) в продуктах находится в виде солянокислого или бромистоводородного тиамина. Он играет важную роль в регулировании белкового, жирового, водного и особенно углеводного обменов, входит в состав фермента пироватдекарбоксилазы, расщепляющего пировиноградную и некоторые другие кисл. Укрепляет иммунную систему. Недостаток витамина вызывает нарушения в деятельности нервной системы, которые проявляются недостаточ ной концентрацей внимания, быстрой умственной и физической утомляемостью, легкой возбудимостью, плохим апетитом. Главными источниками витамина B1 являются пшеничные и рисовые отруби, зародыши злаков, внутренние органы животных (печень, почки, сердце). Особенно много витамина содержится в дрожжах пивных — 163 285 мг/кг, хлебопекарных — 27—66, говядине — 1,7—2 мг/кг. Суточная потребность в витамине B1 для взрослого человека составляет 2—3 мг в зависимости от интенсивности труда, а также количества углеводов, поступающих с пищей. Витамин B1 устойчив при нагревании до 100—120 °С. Витамин В2 (рибофлавин) синтезируется только растениями и некоторыми микроорганизмами, относится к желтым красящим веществам — флавинам. Он необходим для нормального обмена веществ (жиров) в организм» и функционирования нервной системы; катализирует пер», нос водорода ферментами. Недостаточное поступление витамина В2 с пищей вызывает задержку или даже полную приостановку роста молодого организма в результате снижения окислительных процессов а тканях и ослабления процессов обмена веществ. Часто при авитаминозе возникают заболевания глаз, поражения слизистой оболочки в углах рта, усиленное выпадение волос. | Суточная потребность человека в рибофлавине составля-2—3 мг. Важнейшими источниками витамина В2 являются: дрожжи— 4 мг%, печень и почки быка — до 2,5, яйца — 0,8, молоко —0,2, сыр, творог — 0,4—0,5. В2 устойчив при сушке, нагревании и варке; Разрушается в щелочных растворах и под воздействием ультрафиолетовых лучей, высоких температур. Витамин В6 (пиридоксин, адермин) является производным м пиридина. Значение пиридоксина определяется в основном тем, что он входит в виде остатка в состав таких важных ферментов, как аминотрансфераза, декарбоксилаза и др., а также играет огромную роль в превращении аминокислот, процессах обмени веществ (особенно азотного) и в деятельности центральном нервной системы. При отсутствии или недостатке витамина В6 у человека наблюдаются воспалительные поражения кожи. Потребность человека в витамине составляет 1,5—3 мг в сутки. Находится он в сухих дрожжах, печени, мясе, рыбе — до I мг%, фасоли и горохе — 0,7, пшенице — 0,3, картофеле и Капусте — 0,1—0,2 мг%. Пиридоксин устойчив к действию высоких температур, разрушается под действием света. Витамин В9 (фолиевая кислота, фолацин). Как и витамин В12, он оказы вает благотворное влияние при лечении некоторых злокачественных анемий у человека. Недостаток фолиевой кислоты в кормах приводит к задержке роста и процесса кроворерения у животных. Устойчив к кислороду воздуха, высокой температуре; разрушается при длительном воздействии солнечных лучей. Витамин В9 содержится во многих пищевых продуктов печени говяжьей — 160 мкг%, почках — 45, говядине - 10, молоке — 4, яйцах — 11, салате — 40, шпинате — 53, дрожжах прессованных пекарских — 1080 пивных — 1470 мкг% . Из-за того, что фолиевая кислота синтезируется микрофлорой кишечника, суточную потребность в ней определить затруднительно. В 12 это кристаллическое соединение красного цвета. Он является биокатализатором, участвующим в процессах кроветворения. Отсутствие витамина В12 в организме вызывает анемии. Цианокобаламин необходим также для нормальной деятельности нервной системы. Наличие его в пище способствуй лучшему усвоению растительных белков. Витамин B12 применяется при лечении лучевой болезезни. В организме животных и человека синтезируется микрофлорой кишечника. Витамин В12 устойчив при нагревании, разрушается при длительном действии света. Суточная потребность человека в цианокобаламине составляет 2—5 мкг. Главными источниками витамина В12 являются следующие пищевые продукты: говядина — 2—8 мкг% , говяжьи почки —- 20—50, печень — 50—130, сердце — 25, корове молоко — 0,2—0,6, сыр — 1,4—3,6. РРпо характеру действия называют антипеларгическим, так как его отсутствие в организме вызываот пеллагру, что в переводе с итальянского означает «шершавая кожа». Витамин РР входит в состав фермента дегидрогеназы и учавствует обмене веществ; устойчив к внешним воздей-миям: свету, кислороду, высоким температурам. Суточная потребность организма в витамине РР составляет 15—25 мг. Важными его источниками являются: дрожжи — 40 мг, печень — 22, мясо и рыба — 2—6, крупа гречневая 2, капуста — 0,4, молоко — 0,1, хлеб пшеничный 2 сорта — 1,9, грибы сушеные — 40 мг%. Р (биофлаваноид) иногда называют витамином С2, поскольку при лечении тяжелых форм цинги его также необходимо применять. Он обладает способностью повышать прочность стенок капилляров. Витамин Р содержится в зеленом горохе, апельсинах, черной смородине, малине, землянике, зеленом чае. Суточная потребность в нем составляет 25—50 мг. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 1066. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
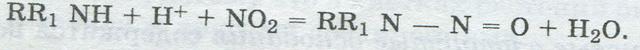
 часть их переходит в нитриты. Предельно допустимая концентрация нитратов для белокочанной капусты составляет 500 мг/кг, картофеля — 250, свеклы — 1400 мг/кг.
часть их переходит в нитриты. Предельно допустимая концентрация нитратов для белокочанной капусты составляет 500 мг/кг, картофеля — 250, свеклы — 1400 мг/кг.