
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
П.1.Розв’язування задач, що приводять до розв’язування рівнянь та систем рівнянь ⇐ ПредыдущаяСтр 6 из 6 Література: 1.Валєєв К. Г., Джалладова І. А. В 15 Елементарна математика для студентів, слухачів ПО, абітурієнтів: Навч. посіб. — К.: КНЕУ, 2006. Методичні вказівки: Задачі на складання рівнянь становлять розділ математики, що традиційно пропонується на вступних іспитах з математики. Під час розв’язування цих задач розвивається логічне мислення, формуються дослідницькі навички, а також уміння виконувати складні перетворення, що виникають у процесі розв’язування відповідних систем рівнянь та нерівностей. Текстові задачі умовно можна поділити на такі головні види: 1) хімічні задачі; 2) задачі на рух; 3) задачі на числа; 4) задачі на відсотки; 5) задачі на роботу; 6) нестандартні задачі. Студенти повинні вміти: Розв’язувати задачі на складання рівняь та їх систем (хімічні задачі, задачі на рух, задачі, в яких кількість невідомих більша за кількість рівнянь системи)
Питання для самоконтролю: 1. Хімічні задачі. Основні ідеї розв’язування 2. Задачі на рух. Основні ідеї розв’язування 3. Задачі, в яких кількість невідомих більша за кількість рівнянь системи. Основні ідеї розв’язування Самостійне вивчення з розв’язуванням задач.
Форми поточного та підсумкового контролю самостійної роботи: 1. Поточний: · усне опитування · розв’язування задач. 2. Підсумковий: · тематична контрольна робота · державна підсумкова атестація
Ми розглянемо лише деякі з основних видів задач [3, 5, 10]. Хімічні задачі Розглядаючи задачі на складання рівнянь, спинимося насамперед на тих, які стосуються понять «концентрація» і «процентний вміст». Зазвичай в умовах таких задач ідеться про утворення сплавів або розчинних сумішей двох чи кількох речовин.  Зазначені задачі розв’язують за таких основних припущень: а) усі утворювані сплави чи суміші однорідні; б) при злитті двох розчинів об’ємом Зауважимо, що останнє співвідношення є саме припущенням, оскільки не завжди виконується в дійсності; при злитті двох розчинів не об’єм, а маса суміші дорівнює сумі мас відповідних складових. Розглянемо для визначеності суміш трьох компонентів При цьому відношення
показують, яку частку повного об’єму суміші становлять об’єми окремих компонентів: Відношення об’єму
називається об’ємною концентрацією цього компонента. Об’ємна концентрація — безрозмірна величина. Сума концентрацій усіх компонентів, що утворюють суміш, дорівнює одиниці: Тому для того, аби структуру розчину, що складається з Якщо відомі концентрації
Рис. 1 Об’ємним процентним умістом компонента А називається величина
тобто концентрація цієї речовини, виражена у відсотках. Якщо відомий процентний уміст речовини А, то її концентрацію визначають за формулою:
Наприклад, якщо процентний уміст становить 70 %, то відповідна концентрація дорівнює 0,7. Процентному вмісту 10 % відповідає концентрація 0,1. Так само (як відношення маси чистої речовини А у сплаві до маси всього сплаву)визначають і масову концентрація та процентний уміст. Про яку концентрацію — об’ємну чи масову — йдеться в конкретній задачі, завжди зрозуміло з її умови. Існує порівняно небагато задач, в яких доводиться перераховувати об’ємну концентрацію на масову чи навпаки. Для того щоб це зробити, необхідно знати густину компонентів, що утворюють розчин чи сплав. Розглянемо, наприклад, двокомпонентну суміш з об’ємними концентраціями компонентів
де
які визначають зв’язок цих величин з об’ємними концентраціями. Як правило, в умовах задач розглядуваного типу повторюється одна й та сама конструкція: із двох чи кількох сумішей, що складаються з компонентів Під час розв’язання таких задач зручно розглядами об’єм чи масу кожної суміші, а також концентрації їхніх компонентів Проілюструємо сказане вище на прикладі наступної задачі. Приклад 1.Маємо два куски сплаву міді і цинку з масовим процентним вмістом міді відповідно р % і q %. В якому відношенні потрібно взяти ці сплави, щоб, переплавивши взяті куски разом, одержати сплав, що містить r % міді? Розв’язування. Побудуємо схему, що унаочнює умову задачі (рис. 2). Концентрація міді в першому сплаві дорівнює р/100, у другому — q/100.
Рис. 2 Якщо першого сплаву взяти х кг, а другого у кг, то за допомогою масових концентрацій можна «розщепити» ці величини на окремі складові:
Маса, кг, міді в утвореному сплаві така:
а маса цього сплаву становитиме
За умовою задачі ця концентрація має дорівнювати r/100. Тому дістаємо рівняння
або
Розв’яжемо здобуте рівняння. Насамперед зазначимо, що рівняння містить дві невідомі х і у.Неважко зрозуміти, що обидві невідомі однозначно не визначаються. Концентрація утворюваного сплаву визначається не масою взятих кусків, а відношенням цих мас. Тому в задачі потрібно визначити не самі значення х та у, а тільки їх відношення. Запишемо рівняння задачі в такому вигляді:
Розглянемо можливі випадки. 1. p = r = q. У цьому випадку концентрації всіх сплавів однакові і рівняння показує, що існує нескінченна множина розв’язків. Можна взяти скільки завгодно першого сплаву і скільки завгодно другого сплаву. 2. p = r ¹ q. У цьому випадку рівняння набирає вигляду
звідки знаходимо: х — будь-яке, у = 0.Фізичний зміст цього розв’язку зрозумілий: якщо концентрація сплаву, який потрібно одержати, збігається з концентрацією першого сплаву, але не дорівнює концентрації другого сплаву, то першого сплаву можна взяти скільки завгодно, а другого сплаву не брати зовсім. 3. p ¹ r = q. Дістаємо рівняння
звідки знаходимо: у — будь-яке, х = 0. 4. р ¹ м, р ¹ q, q ¹ r. У цьому випадку можна записати:
Оскільки у ¹0, то
Це значення буде розв’язок задачі, якщо виконується нерівність
Неважко показати, що ця нерівність справджується, якщо значення r міститься між значеннями р та q. Таким чином, якщо р ¹ q,то можна одержати сплав із будь-яким процентним вмістом міді між р і q. Незважаючи на те, що цей приклад дуже простий, він доволі добре ілюструє основний метод розв’язування задач, пов’язаних із сумішами. Розглянемо ще одну задачу.
Якщо в посудині об’єму V0, містить р % розчин солі. Із посудини виливається а п суміші і додається а л води. Ця процедура повторюється п разів. Тоді концентрація солі в розчині після п переливань визначається формулою:
Приклад 2.У посудині об’ємом V0 міститься а л солі. Значення a/V0 відоме. Після скількох переливань концентрація солі в розчині зменшиться більш ніж у k раз? Розв’язування.
Використовуючи формулу (2) для концентрації солі в розчині після п переливань, дістаємо
Звідси знаходимо
Найменша кількість таких переливань дорівнює
Приклад 3. Відомо, що після п переливань концентрація солі в розчині зменшилася в k раз. Визначити, яку частину об’єму посудини становлять а л. Розв’язування.
Відповідно до формули (2), якою подається концентрація солі в розчині після п переливань, маємо
або
Звідси знаходимо шукане відношення:
Зауваження. Формула (2) пов’язана з правилом нарахування «складних відсотків». Про «складні відсотки» говорять у тому разі, коли значення деякої величини поетапно змінюється, причому на кожному етапі зміна становить певну кількість відсотків від значення, що його ця величина мала на попередньому етапі. Розглянемо спочатку випадок, коли наприкінці кожного етапу значення величини змінюється на ту саму сталу кількість р від- Деяка величина А, вихідне значення якої дорівнює А0, наприкінці першого етапу матиме значення
Наприкінці другого етапу її значення становитиме
Тут множник Наприкінці третього етапу
і т. д. Неважко зрозуміти, що наприкінці п-го етапу значення величини А подається формулою:
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 249. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 Лекційний матеріал до теми.
Лекційний матеріал до теми. і
і  утворюється суміш, об’єм
утворюється суміш, об’єм  якої дорівнює
якої дорівнює  :
:
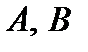 і
і 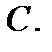 Обсяг суміші
Обсяг суміші 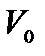 складається з обсягів чистих компонентів:
складається з обсягів чистих компонентів:





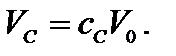
 чистого компонента в розчині до всього об’єму
чистого компонента в розчині до всього об’єму 

 компонентів, було визначено, достатньо знати концентрацію
компонентів, було визначено, достатньо знати концентрацію  -го компонента.
-го компонента. і
і  компонентів, що утворюють дану суміш, то її об’єм можна поділити на об’єми окремих компонентів (рис. 1):
компонентів, що утворюють дану суміш, то її об’єм можна поділити на об’єми окремих компонентів (рис. 1): (1)
(1)


 і
і 
 і густиною компонентів, що дорівнює відповідно
і густиною компонентів, що дорівнює відповідно  і
і  Масу суміші можна знайти за формулою
Масу суміші можна знайти за формулою
 і
і 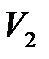 — об’єми компонентів суміші. Масові концентрації компонентів подаються залежностями:
— об’єми компонентів суміші. Масові концентрації компонентів подаються залежностями:

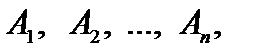 утворюється нова суміш шляхом перемішування вихідних сумішей, узятих у певній пропорції. При цьому потрібно знайти, в якому відношенні компоненти
утворюється нова суміш шляхом перемішування вихідних сумішей, узятих у певній пропорції. При цьому потрібно знайти, в якому відношенні компоненти 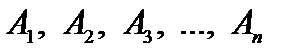 увійдуть у суміш, що вийшла.
увійдуть у суміш, що вийшла. Відповідно до концентрацій потрібно «розщепити» кожну суміш на окремі компоненти, як це зроблено у формулі (1), а далі згідно з умовою задачі скласти нову суміш. При цьому легко підрахувати, який об’єм (яка маса) кожного компонента входить у суміш, що вийшла, а також повний об’єм (повну масу) цієї суміші. Після цього визначаються концентрації компонентів
Відповідно до концентрацій потрібно «розщепити» кожну суміш на окремі компоненти, як це зроблено у формулі (1), а далі згідно з умовою задачі скласти нову суміш. При цьому легко підрахувати, який об’єм (яка маса) кожного компонента входить у суміш, що вийшла, а також повний об’єм (повну масу) цієї суміші. Після цього визначаються концентрації компонентів  у новій суміші.
у новій суміші.
 (кг міді) +
(кг міді) +  (кг цинку);
(кг цинку); (кг міді) +
(кг міді) +  (кг цинку).
(кг цинку). ,
, кг. Звідси знаходимо нову концентрацію міді в сплаві:
кг. Звідси знаходимо нову концентрацію міді в сплаві:







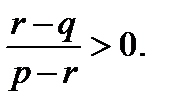
 (2)
(2)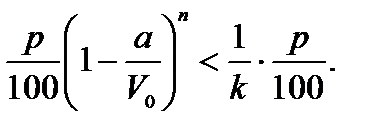

 . ×
. ×

 ×
×

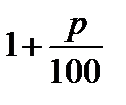 показує, у скільки разів значення величини збільшилося за один етап. У попередніх задачах про концентрації цю роль відігравав множник
показує, у скільки разів значення величини збільшилося за один етап. У попередніх задачах про концентрації цю роль відігравав множник 

