
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Идеальный газ. Уравнение Клапейрона-Менделеева.
Идеальный газ. При построении модели идеального газа абстрагируются от некоторых свойств реальных газов, например пренебрегают силами межмолекулярного взаимодействия. Молекулы рассматриваются как абсолютно упругие частицы, объем которых пренебрежимо мал по сравнению с объемом газа. Модель идеального газа является абстрактной, отражает приближенные свойства реальных рабочих тел. Равновесное состояние идеального газа описывается уравнением Клапейрона — Менделеева После деления левой и правой частей уравнения
Газовая постоянная. Универсальная газовая постоянная.
Равновесное состояние идеального газа описывается уравнением Клапейрона — Менделеева  После деления левой и правой частей уравнения
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 493. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
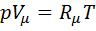 , где р — давление, Па;
, где р — давление, Па; 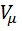 — молярный объем газа, м3/моль;
— молярный объем газа, м3/моль; 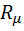 — универсальная газовая постоянная, Дж/(мольК). Универсальная газовая постоянная численно равна работе 1 моля газа в изобарном процессе при повышении температуры на один Кельвин.
— универсальная газовая постоянная, Дж/(мольК). Универсальная газовая постоянная численно равна работе 1 моля газа в изобарном процессе при повышении температуры на один Кельвин. 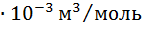 . Тогда
. Тогда 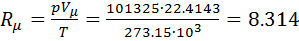 Дж/(мольК).
Дж/(мольК).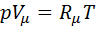 на молярную массу
на молярную массу  получим уравнение состояния идеального газа в виде рv = RТ, где R — газовая постоянная, зависящая от природы газа и принимающая для различных газов определенные значения, Дж/(кгК).
получим уравнение состояния идеального газа в виде рv = RТ, где R — газовая постоянная, зависящая от природы газа и принимающая для различных газов определенные значения, Дж/(кгК).