
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Закон Дальтoна. Парциальное давление.Под парциальным давлением понимается такое давление, которое оказал бы газ, входящий в состав смеси, если бы он находился один в том же объеме Vи при той же температуреТ, что и в смеси. Закон Дальтона: каждый отдельный газ ведет себя в газовой смеси так, как будто бы он один при температуре смеси занимает весь объем. По закону Дальтона давление смеси газов, в которой нет химических реакций между компонентами, равно сумме парциальных давлений отдельных газов: Просуммируем левую и правую части уравнения Приравнивая правые части уравнений, найдем газовую постоянную смеси Используя формулы перехода Средняя молярная масса является условной величиной, под которой понимается молярная масса некоторого однородного газа такой же массы, что и у изучаемой смеси, и тождественного посвоим физическим свойствам данной смеси.
Газовая постоянная и средняя молярная масса смеси.
Газовая постоянная (R) – одна из основных физических постоянных, входит в уравнение состояния 1 моля идеального газа: pV = RT, где р – давление, V – объем моля газа, Т – абсолютная температура. Газовая постоянная численно равна работе расширения 1 моля идеального газа под постоянным давлением при нагревании на 1 K. R = pV/T = 1.01•105•22.4•10-3/273[Па•м3/моль]/K =8.31(44) Dж/(моль•K)  Уравнение для нахождения удельной газовой постоянной смеси:
R = еgiRi= 8314,2(g1/ M1+ g2/ M2+… + gn/ Mn) Зная молярную массу смеси, можно найти газовую постоянную смеси:
R = 8,314 / M. Зная объемный состав смеси, получим следующие формулы: gi= (R / Ri), еgi = Rе(ri / Ri) = 1. Формула для вычисления удельной газовой постоянной примет вид: R= 1 / е(ri/Ri) = 1 / (r1/ R1 + R2+… + rn / Rn).
Средняя молярная масса смеси газов является достаточно условной величиной:
M = 8314,2 / R, M= 8314,2 / (g1R1+ g2R2 +. + gnRn). Если произвести замену удельных газовых постоянных R1, R2,…, Rn их значениями из уравнения Клайперона, найдем среднюю молярную массу смеси газов, если смесь определяется массовыми долями:
M= 1 / (r1/ M1+ r2/ M2+. + rn/ Mn). В случае, когда смесь определяется объемными долями, получаем следующее выражение: R= 1 / еriRi = 8314,2 / еriMi. Зная, что R = 8314,2 / M, получим: M= еriMi = r1M1 + r2M2 +. + rnMn. Таким образом, средняя молярная масса смеси газов определяется суммой произведений объемных долей на молярные массы отдельных газов, из которых состоит смесь. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 522. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
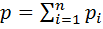 .
.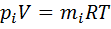 :
: 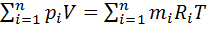 ИЛИ
ИЛИ 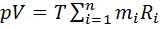 Уравнение Клапейрона для смеси имеет вид pv=mRT.
Уравнение Клапейрона для смеси имеет вид pv=mRT. Газовая постоянная смеси газов равна сумме произведений массовых долей отдельных газов, на их газовую постоянную. Универсальная газовая постоянная
Газовая постоянная смеси газов равна сумме произведений массовых долей отдельных газов, на их газовую постоянную. Универсальная газовая постоянная 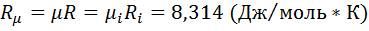 , откуда средняя молярная масса газовой смеси
, откуда средняя молярная масса газовой смеси 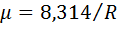 (можно расписать R) где
(можно расписать R) где 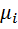 — молярная масса i-го компонента.
— молярная масса i-го компонента.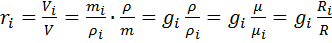 получим:
получим: 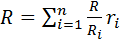 и
и 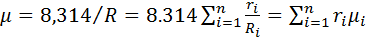 .
.