
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Понятия и определения теплоемкости.
Под теплоемкостью тела понимают кол-во тепла которое необходимо сообщить телу для того чтобы нагреть его на один градус. Из этого определения следует, что теплоемкость вещества является экстенсивным свойством тела. Величина теплоемкости данного тела тем больше чем больше вещества в теле. Удельная теплоемкость: Средняя и истинная теплоемкость.Значение средней теплоемкости Чем больше используется членов тем точнее
Величина удельного кол-ва тепла зависит не только от интервала температур но и от вида процесса. Поэтому величина q должна быть снабжена индексом хар-им вид процесса.
Теплоемкость смеси идеальных газов. Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость. Для определения теплоемкости смеси газов необходимо знать состав смеси и теплоемкость отдельных газов, входящих в смесь.  Предположим, что состав смеси задан массовыми долями компонентов. Напишем выражения для количества теплоты, сообщаемого i-му газу:
Изотермический процесс.
Изотермический процесс. Процесс, протекающий при постоянной температуре, называется изотермическим. Уравнение изотермического процесса в системе координатТ— sT = соnst. Изотерма на диаграммеТ— s представлена прямой, параллельной оси абсцисс (оси s). Подставляя T = соnst в уравнение состояния идеального газа, получим изотерма на диаграмме р— vпредставляет равнобокую гиперболу. Запишем уравнения для дифференциалов внутренней энергии и энтальпии:
Изобарный процесс.
Изобарный процесс. Изобарный процесс —
процесс, протекающий при постоянном давлении газа ( Для изобарного процесса последнее уравнение перепишется так: В процессе 1-2теплота подводится, газ расширяется, увеличиваются температура и энтропия газа, в процессе 1—2' теплота отводится, газ сжимается, температура и энтропия уменьшаются. Подставим в уравнения первого закона термодинамики соотношение, характерное для изобарного процесса pdv=RdT. Разделив полученное выражение на dТ, получаем Изохорный процесс.
Изохорный процесс.Изохорный процесс - процесс.происходящий при постоянном объеме газа: Внутренняя энергия идеального газа во всех процессах, протекающих в одном и том же интервале температур, изменяется на одну и ту же величину независимо от характера процесса. Вследствие этого выражение На диаграмме Т-sподкасательная к кривой процесса в любой ее точке определяет истинное значение удельной изохорной теплоемкости Адиабатный процесс. Адиабатный процесс. Адиабатный процесс протекает без теплообмена системы с окружающей средой, система не получает теплоты извне и не отдает ее. Условие протекания адиабатного процесса dq=0. Уравнения первого закона термодинамики при dq=0 имеют вид Полезная внешняя работа Равновесный адиабатный процесс является процессом изоэнтропным. Из сравнительного анализа уравнений адиабаты и изотермы следует, что адиабата круче изотермы на диаграмме p-v.
Политpoпные процессы.
Политропный процесс. Политропный процесс проходит при постоянной теплоемкости ( Значение показателя политропыпопределяет характер протекания политропного процесса. Процессы с подводом теплоты и увеличением энтропии располагаются в областях I—III, VIII, с отводом теплоты от системы и уменьшением энтропии -в областях IV—VII. В областях VII, VIII, Iи II термодинамические процессы идут с повышением температуры рабочего тела, в остальных областях — с ее понижением. В области III протекают процессы с подводом тепла и понижением температуры, в области VI — с отводом тепла и повышением температуры. На диаграмме р-v правее, а на диаграмме Т—s выше изотермы процессы идут с увеличением внутренней энергии, в остальных областях — с уменьшением внутренней энергии рабочего тела
26. Уравнение первого закона термодинамики для потока.
Первый закон термодинамики для потока
На практике при рассмотрении рабочих процессов машин, аппаратов и устройств, встречаются задачи изучении закономерностей движения рабочих тел (газов, пара и жидкостей).
Уравнение 1-го закона термодинамики для потока газа при следующих допущениях: движение газа по каналу установившееся и неразрывное; скорости по сечению, перпендикулярному оси канала, постоянны; пренебрегается трение частичек газа друг другу и о стенки канала; изменение параметров по сечению канала мало по сравнению их абсолютными значениями,
имеет вид: q = Du + De + lпрот. + lтехн. , (5.1) где De = (w22 – w21)/2 + g·(z2 –z1) – изменение энергии системы, состоящий из изменения кинетической и потенциальной энергий; w1 ,w2 – скорости потока в начале и в конце канала; z1 , z2 – высота положения начала и конца канала. lпрот. = P2·n 2 – P1·n 1– работа проталкивания, затрачиваемая на движения потока; lтехн. – техническая (полезная) работа (турбины, компрессора, насоса, вентилятора и т.д.). q = (u2 – u1) + (w22 – w21)/2 + g·(z2 –z1) + P2·n 2 – P1·n 1 + lтехн. (5.2) Введем понятия энтальпии, который обозначим через величину: h = u + Pх , (5.3) h2 = u2 + P2·n2 ;h1 = u1 + P1·n 1 . (5.4) Тогда уравнение 1-го закона термодинамики для потока газа будет иметь вид: q = h2 – h1 + (w22 – w21)/2 + g·(z2 –z1) + lтехн. (5.5)
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 619. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 .
. Теплоемкость не является постоянной величиной, она изменяется с изм. температуры, причем в ряде случаев эта зависимость значительна.
Теплоемкость не является постоянной величиной, она изменяется с изм. температуры, причем в ряде случаев эта зависимость значительна. 
 . Значение истинной теплоемкости определяется как производная от количества тепла подводимого к телу в процессе нагрева к температуре этого тела:
. Значение истинной теплоемкости определяется как производная от количества тепла подводимого к телу в процессе нагрева к температуре этого тела: 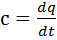 .
. 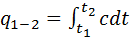 .
. , а истинная теплоемкость в сост. 1 и 2 -
, а истинная теплоемкость в сост. 1 и 2 - 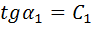 ,
,  .
.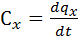 . Наиболее часто используются теплоемкости изобарного и изохорного процессов.
. Наиболее часто используются теплоемкости изобарного и изохорного процессов.
 и к смеси газов
и к смеси газов 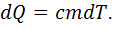 Очевидно, что
Очевидно, что  .
.  . Отсюда удельная теплоемкость газовой смеси
. Отсюда удельная теплоемкость газовой смеси  ; молярная теплоемкость
; молярная теплоемкость  . Применяя формула перехода от массовых долей к объемным, получим:
. Применяя формула перехода от массовых долей к объемным, получим: 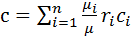 и
и  .
.

 для конечного процесса 1 — 2
для конечного процесса 1 — 2 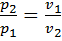 . При изотермическом процессе объем газа обратно пропорционален давлению (закон Бойля — Мариотта). В соответствии с
. При изотермическом процессе объем газа обратно пропорционален давлению (закон Бойля — Мариотта). В соответствии с 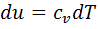 ;
; 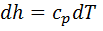 . Для изотермического процесса(dT=0) получаем:
. Для изотермического процесса(dT=0) получаем: 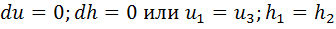 . Внутренняя энергия и энтальпия в изотермическом процессе не изменяются. Из первого закона термодинамики dq=dl получаем для процесса 1—2:
. Внутренняя энергия и энтальпия в изотермическом процессе не изменяются. Из первого закона термодинамики dq=dl получаем для процесса 1—2: 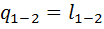 . Количество теплоты, сообщенной газу в изотермическом процессе, численно равно работе расширения. Для рассматриваемого процесса коэффициент
. Количество теплоты, сообщенной газу в изотермическом процессе, численно равно работе расширения. Для рассматриваемого процесса коэффициент  0. Теплота идет на эквивалентное возмещение внутренней энергии системы, за счет которой совершается работа расширения. Работа изменения объема в процессе 1 - 2:
0. Теплота идет на эквивалентное возмещение внутренней энергии системы, за счет которой совершается работа расширения. Работа изменения объема в процессе 1 - 2:  . Полезная внешняя работа в изотермическом процессе равна работе расширения, так как
. Полезная внешняя работа в изотермическом процессе равна работе расширения, так как  , поэтому
, поэтому  . Для процесса 1 — 2
. Для процесса 1 — 2  , или
, или  . Теплоемкость в изотермическом процессе
. Теплоемкость в изотермическом процессе  . Изменение энтропии в процессе 1—2 определится из уравнения
. Изменение энтропии в процессе 1—2 определится из уравнения  или
или  .
.
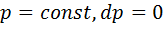 ). Изобара на диаграмме р— vпредставлена прямой, параллельной оси абсцисс. Из уравнения состояний Клапейронапри
). Изобара на диаграмме р— vпредставлена прямой, параллельной оси абсцисс. Из уравнения состояний Клапейронапри  следует
следует 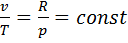 , для процесса 1— 2
, для процесса 1— 2  . В изобарном процессе объем газа пропорционален термодинамической температуре (закон Гей-Люссака). Уравнение первого закона термодинамики представим следующим образом:
. В изобарном процессе объем газа пропорционален термодинамической температуре (закон Гей-Люссака). Уравнение первого закона термодинамики представим следующим образом: 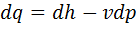 .
. для процесса 1-2
для процесса 1-2  . Теплота, сообщаемая газу в изобарном процессе, идет на увеличение его энтальпии. Работа изменения объема в процессе 1-2
. Теплота, сообщаемая газу в изобарном процессе, идет на увеличение его энтальпии. Работа изменения объема в процессе 1-2  или учитывая, что
или учитывая, что  ,
,  , а
, а 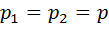 , получим
, получим 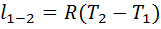 . При разности температур
. При разности температур 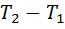 в один кельвин газовая постоянная является работой расширения, совершаемой в изобарном процессе 1 кг газа. Количество теплоты, полученной газом в изобарном процессе
в один кельвин газовая постоянная является работой расширения, совершаемой в изобарном процессе 1 кг газа. Количество теплоты, полученной газом в изобарном процессе 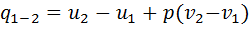 . Коэффициент 𝜁 для изобарного процесса определяется по формуле
. Коэффициент 𝜁 для изобарного процесса определяется по формуле  . Илн, если принять
. Илн, если принять  , где k-показатель адиабаты, 𝜁=1/k. Например, при k= 1,4 (для воздуха) 𝜁=0,715. Это означает, что 71,5% сообщаемой газу теплоты идет на изменение его внутренней энергии, а 28,5 % расходуется на совершение работы расширения. Уравнение изобары в системе координат Т — s можно получить из зависимостей:
, где k-показатель адиабаты, 𝜁=1/k. Например, при k= 1,4 (для воздуха) 𝜁=0,715. Это означает, что 71,5% сообщаемой газу теплоты идет на изменение его внутренней энергии, а 28,5 % расходуется на совершение работы расширения. Уравнение изобары в системе координат Т — s можно получить из зависимостей:  ;
;  откуда для процесса 1-2 получаем
откуда для процесса 1-2 получаем 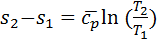 . Изобара на диаграмме T-s представлена логарифмической кривой. Под касательная к изобаре на этой диаграмме в любой точке в определенном масштабе представляет собой истинную изобарную теплоемкость ср. Удельное количество теплоты
. Изобара на диаграмме T-s представлена логарифмической кривой. Под касательная к изобаре на этой диаграмме в любой точке в определенном масштабе представляет собой истинную изобарную теплоемкость ср. Удельное количество теплоты  , а так как
, а так как  . Соотношения
. Соотношения  справедливы для всех процессов идеального газа.
справедливы для всех процессов идеального газа. , откуда
, откуда 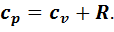 Это уравнение Р. Майера. Из него видно, что удельная изобарная теплоемкость всегда больше удельной изохорной на газовую постоянную.
Это уравнение Р. Майера. Из него видно, что удельная изобарная теплоемкость всегда больше удельной изохорной на газовую постоянную. . В соответствии с данным уравнением изохорный процесс изображается на диаграмме р-vвертикальной прямой. Эта линия называется изохорой (линия 1–2 - теплота подводится, давление возрастает; линия 1-2' - теплота отводится, давление уменьшается). Из уравнения состояния идеального газа для изохорного процесса
. В соответствии с данным уравнением изохорный процесс изображается на диаграмме р-vвертикальной прямой. Эта линия называется изохорой (линия 1–2 - теплота подводится, давление возрастает; линия 1-2' - теплота отводится, давление уменьшается). Из уравнения состояния идеального газа для изохорного процесса  , или для процесса 1-2
, или для процесса 1-2 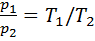 . В изохорном процессе давление газа пропорционально термодинамической температуре. Это соотношение представляет собой закон Шарля. Запишем уравнение первого закона термодинамики в виде
. В изохорном процессе давление газа пропорционально термодинамической температуре. Это соотношение представляет собой закон Шарля. Запишем уравнение первого закона термодинамики в виде  . Для изохорного процесса работа изменения объема не совершается, так как dl=pdv=0. Поэтому последнее уравнение принимает вид dq=du, или для процесса 1-2
. Для изохорного процесса работа изменения объема не совершается, так как dl=pdv=0. Поэтому последнее уравнение принимает вид dq=du, или для процесса 1-2  . Теплота, сообщаемая газу или отведенная от него в изохорном процессе, идет на изменение внутренней энергии (𝜁=1). При подведении теплоты внутренняя энергия газа увеличивается, при отведении - уменьшается. Элементарное количество теплоты при изохорном процессе
. Теплота, сообщаемая газу или отведенная от него в изохорном процессе, идет на изменение внутренней энергии (𝜁=1). При подведении теплоты внутренняя энергия газа увеличивается, при отведении - уменьшается. Элементарное количество теплоты при изохорном процессе  или
или 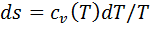 , или для процесса 1-2:
, или для процесса 1-2:  . График изохорного процесса на диаграммеТ- s представляет логарифмическую кривую (кривая 1-2 - тепло подводится, энтропия и температура возрастают; кривая 1-2'—тепло отводится, энтропия и температура уменьшаются). Количество теплоты, сообщаемое газу или отводимое от него в процессе 1-2 (2'),
. График изохорного процесса на диаграммеТ- s представляет логарифмическую кривую (кривая 1-2 - тепло подводится, энтропия и температура возрастают; кривая 1-2'—тепло отводится, энтропия и температура уменьшаются). Количество теплоты, сообщаемое газу или отводимое от него в процессе 1-2 (2'),  ;
;  . Причем чем больше теплоемкость
. Причем чем больше теплоемкость  . Изменение энтальпии в изохорном процессе определяем из уравнения
. Изменение энтальпии в изохорном процессе определяем из уравнения  . Дифференцируем это выражение:
. Дифференцируем это выражение: 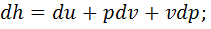 получаем (pdv=0)
получаем (pdv=0)  , для процесса 1-2
, для процесса 1-2  , или
, или  .
.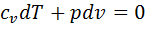 и
и  откуда получаем
откуда получаем 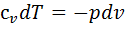 ;
;  . Разделив почленно второе уравнение на превое:
. Разделив почленно второе уравнение на превое:  , или
, или 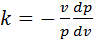 . После разделения переменных получим
. После разделения переменных получим 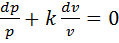 , после интегрирования –
, после интегрирования – 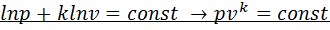 (1). Или для процесса 1-2
(1). Или для процесса 1-2  . Уравнение (1)является уравнением адиабатного процесса. При его выводе предполагалось, что
. Уравнение (1)является уравнением адиабатного процесса. При его выводе предполагалось, что  являются постоянными величинами. Элементарная удельная работа изменения объема в адиабатном процессе определяется по формуле
являются постоянными величинами. Элементарная удельная работа изменения объема в адиабатном процессе определяется по формуле  , откуда
, откуда  . Умножив и разделив правую часть выражения (2)на
. Умножив и разделив правую часть выражения (2)на  , получим
, получим 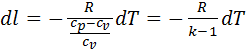 , или
, или 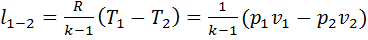 . Из первого закона термодинамики следует, что при
. Из первого закона термодинамики следует, что при  . Работа изменения объема в адиабатном процессе осуществляется за счет внутренней энергии системы: при совершении работы расширения внутренняя энергия газа и температура уменьшаются, при адиабатном сжатии газа внутренняя энергия и температура возрастают.
. Работа изменения объема в адиабатном процессе осуществляется за счет внутренней энергии системы: при совершении работы расширения внутренняя энергия газа и температура уменьшаются, при адиабатном сжатии газа внутренняя энергия и температура возрастают. . Полезная внешняя работа при адиабатном процессе в kраз больше работы изменения объема. Дифференциал энтропии ds=dq/T, откуда при dq=0 ds=0, s=const.
. Полезная внешняя работа при адиабатном процессе в kраз больше работы изменения объема. Дифференциал энтропии ds=dq/T, откуда при dq=0 ds=0, s=const.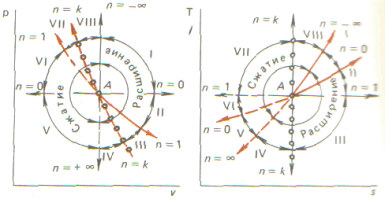
 ). Коэффициент 𝜁 в политропном процессе имеет определенное постоянное числовое значение. Элементарное количество теплоты для любого политропного процесса
). Коэффициент 𝜁 в политропном процессе имеет определенное постоянное числовое значение. Элементарное количество теплоты для любого политропного процесса 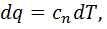 где
где 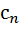 — удельная теплоемкость при политропном процессе, или для процесса 1—2
— удельная теплоемкость при политропном процессе, или для процесса 1—2  . Выведем уравнение политропного процесса. Из первого закона термодинамики имеем:
. Выведем уравнение политропного процесса. Из первого закона термодинамики имеем:  откуда
откуда  Введя обозначение
Введя обозначение 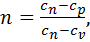 получаем
получаем  Интегрируем полученное выражение для процесса 1—2:
Интегрируем полученное выражение для процесса 1—2: 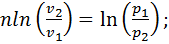 после потенцирования получаем
после потенцирования получаем  уравнение политропного процесса. Величина пназывается показателем политропы, который может принимать значения от
уравнение политропного процесса. Величина пназывается показателем политропы, который может принимать значения от  . Удельная работа изменения объема в политропном процессе
. Удельная работа изменения объема в политропном процессе  Удельная полезная внешняя работа определяется по следующей формуле:
Удельная полезная внешняя работа определяется по следующей формуле: 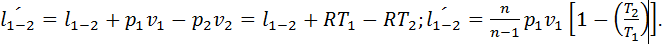 Изменение внутренней энергии и энтальпии в политропном процессе
Изменение внутренней энергии и энтальпии в политропном процессе  и
и  =const,
=const,  Изменение внутренней энергии и энтальпии в политропном процессе пропорционально приращению температуры. Для практических расчетов необходимо знать значение показателя политропып. Один из методов определения пзаключается в логарифмировании уравнения политропы для двух характерных точек 1 и 2:
Изменение внутренней энергии и энтальпии в политропном процессе пропорционально приращению температуры. Для практических расчетов необходимо знать значение показателя политропып. Один из методов определения пзаключается в логарифмировании уравнения политропы для двух характерных точек 1 и 2:  откуда показатель политропы
откуда показатель политропы  Основные термодинамические процессы являются частными случаями политропных процессов (при
Основные термодинамические процессы являются частными случаями политропных процессов (при  имеем изохорный процесс, n=0 изобарный, n=1 изотермический,n=k адиабатный).
имеем изохорный процесс, n=0 изобарный, n=1 изотермический,n=k адиабатный).