
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Понятие термодинамического процесса и термодинамическое равновесие.
Термодинамический процесс -- совокупность непрерывно изменяющихся состояний термодинамической системы. Причиной возникновения термодинамических процессов является взаимодействие системы и окружающей среды. Признаком процесса является изменение хотя бы одного из термодинамических параметров состояния системы. Для возникновения процессов в системе, находящейся в состоянии термодинамического равновесия, необходимы внешние воздействия. Интенсивность взаимодействия определяется движущей силой процесса, которая равна разности внешних и внутренних потенциалов Термодинамическое равновесие. Взаимодействие системы и среды возможно только при наличии разности соответствующих потенциалов. Отсюда следует, что при равенстве внешних и внутренних потенциалов система не взаимодействует с окружающей средой, не происходит обмена энергией и веществом с другими телами, т. е. система находится в состоянии термодинамического равновесия. Самопроизвольный выход из этого состояния (без внешних воздействий) для системы невозможен. Условие равновесия может быть представлено равенством Термодинамическое равновесие, по существу, является равновесием макрофизическим. Микрофизические процессы (движение молекул, атомов, взаимодействие элементарных частиц) не прекращаются в системах, находящихся в равновесном состоянии. Микро движение не зависит от макроскопического состояния системы и, более того, обусловливает состояние термодинамического равновесия. Например, постоянная температура газа обусловливается постоянством средней кинетической энергий движения молекул газа и т. д.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 460. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

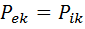 .
.