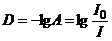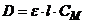Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Потенциометрическое титрованиеЯвляется методом объемного анализа, в котором конец титрования определяют по резкому изменению потенциала индикаторного электрода вблизи точки эквивалентности. Это объясняется тем, что между электродным потенциалом и показателем концентрации (активности) ионов или показателем отношения окислителя к восстановителю существует линейная зависимость. Таким образом, потенциометрическое титрование, как и обычное титрование, основано на резком изменении вблизи точки эквивалентности концентрации анализируемого вещества при прибавлении к раствору небольшого количества титрующего реагента. Выбор индикаторного электрода при потенциометрическом титровании определяется типом протекающей реакции и природой присутствующих в растворе ионов. При реакциях окисления – восстановления в качестве индикаторного электрода чаще всего используют электроды из индифферентного металла (платины, золота). При реакциях нейтрализации индикаторными могут служить различные электроды, потенциал которых зависит от рН, (стеклянный, водородный). При реакциях осаждения и комплексообразования обычно используют электроды, потенциал которых является функцией концентрации (активности) ионов, принимающих участие в реакции комплексообразования или осаждения. Например, серебряный электрод может быть использован при определении серебра, а также ряда ионов (Cl-, Br-, I-, S2- CN-), дающих с ионами серебра малорастворимые соли или прочные комплексы. При потенциометрическом титровании, как и при любом другом титровании, необходимо определить точки эквивалентности. Для нахождения точки эквивалентности наиболее простым и удобным способом является графическое построение кривой титрования. При этом на оси абсцисс откладывают объем прилитого титрованного раствора (V), а на оси ординат – соответствующие значения ЭДС ячейки (Е). точку эквивалентности находят по перегибу кривой титрования 
Более точно точка эквивалентности находится по пересечению ветвей дифференциальной кривой титрования, построенной в координатах
Спектральный анализ Общие сведения Классификация спектров Спектральный анализ – группа методов определения состава и строения вещества по его спектру. Спектром называют упорядоченное по длинам волн электромагнитное излучение. При сообщении веществу энергии в нем происходят процессы (возбуждение электронов – внешних или внутренних, усиление вращательного или колебательного движения молекул), которые сопровождаются появлением линий или полос в спектре. Соответственно выделяют спектры линейчатые, полосатые, сплошные. Частицы, являющиеся источником света, должны находиться на достаточно большом расстоянии друг от друга, чтобы их излучение можно считать независимым.
В зависимости от характера возбуждения и процессов в веществе можно выделить спектры поглощения и испускания.
Законы спектрального анализа. Условие Бора Атомы и ионы всех элементов могут находиться в нормальном (основном) и возбужденном состояниях. В нормальном состоянии атомы обладают минимальной энергией Еi и в этом случае не излучают. Под влиянием внешних воздействий (температура, поток быстрых частиц и др.) происходит переход электронов атома с нормального уровня энергии Еi на один из более высоких уровней Еk. По истечении некоторого времени (10-7 - 10-8 с) каждый возбужденный атом самопроизвольно возвращается в нормальное состояние Ei. Освобождающаяся при этом энергия излучается в виде кванта света hν и наблюдается в виде одной спектральной лини с определенной длиной волны согласно закону Бора:
Число возможных энергетических переходов и, следовательно, число спектральных линий определяется строением электронных уровней атомов. Так как в излучении принимают участие много атомов с различными начальными энергиями, то в спектре излучения наблюдаются линии, обусловленные всеми возможными энергетическими переходами, присущими этому элементу.
В том случае, когда энергия кванта попадающего на вещество света (или другого излучения) совпадает с разностью энергий основного и возбужденного состояний молекулы происходит поглощение квантов электромагнитного излучения. Вызванные поглощением определенных квантов энергии электронные переходы характеризуются строго определенными полосами поглощения в электронных спектрах поглощающих молекул. На способности атомов и молекул поглощать свет с определенной длиной волны основан анализ по электронным спектрам поглощения. Закон Бугера-Ламберта-Бера Спектр поглощения является индивидуальной характеристикой вещества на определенной длине волны. Характер и величина поглощения света зависят от природы вещества и его концентрации в растворе. Это и используют как для качественного, так и количественного анализа.
Если обозначить I0 интенсивность падающего света, а I – интенсивность света после прохождения через слой раствора, то отношение
характеризует пропускание света слоем раствора. Величина пропускания А может изменяться от 0 до 1. Если величина А отнесена к толщине слоя 1 см, то она называется коэффициентом пропускания или экстинкцией e раствора. Величина экстинкции зависит от свойств поглощающего свет вещества и для каждого данного вещества остается постоянной. Поглощение излучения характеризуют величиной оптической плотности D:
Величина оптической плотности может принимать любые значения (от 0 до ¥), однако современные приборы позволяют измерять величины оптической плотности, не превышающие 10. С концентрацией раствора оптическая плотность связана законом Бугера-Ламберта-Бера:
где С – концентрация вещества, моль/л; l – толщина слоя раствора, поглощающего свет, см; e - коэффициент экстинкции. Закон Бугера-Ламберта-Бера выполняется для любого метода анализа по спектрам поглощения. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 405. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |



 , где ΔЕ = Еn+1 − En, например, ΔЕ1 = Е1 − Е0, ΔЕ2 = Е2 − Е1 и т. д., ΔV – шаг титрования.
, где ΔЕ = Еn+1 − En, например, ΔЕ1 = Е1 − Е0, ΔЕ2 = Е2 − Е1 и т. д., ΔV – шаг титрования.