
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
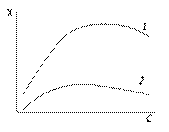
Зависимость электропроводности растворов электролитов от концентрацииЗависимость удельной электрической проводимости растворов электролитов от концентрации показана на рис.
Удельная электрическая проводимость раствора электролита определяется количеством ионов, переносящих электричество и скоростью их передвижения:
Для раствора бинарного электролита заданной концентрации:
где a – степень диссоциации электролита (для разбавленных растворов сильных электролитов a = 1); С – нормальная концентрация электролита, экв/л; F – число Фарадея; u+ и u– - подвижности катиона и аниона соответственно. В разбавленных растворах сильных и слабых электролитов рост электрической проводимости с концентрацией обусловлен увеличением числа ионов, переносящих электричество. У слабых электролитов в концентрированных растворах заметно снижается степень диссоциации и, следовательно, число ионов, переносящих электричество.
Эквивалентная электропроводность связана с подвижностью иона выражением: li = a·F·ui , где li – удельная электропроводность катиона либо аниона; ui - подвижность катиона либо аниона. Отсюда значения электропроводности могут быть выражены:
и
С уменьшением концентрации раствора (увеличением разведения) удельная электропроводность возрастает и при Эквивалентная электропроводность бесконечно разбавленного раствора описывается уравнением:
Произведение 
Таким образом, предельная эквивалентная электропроводность равна сумме предельных эквивалентных электропроводностей ионов при бесконечном разбавлении (закон Кольрауша или независимого движения ионов). Предельная эквивалентная электропроводность является специфической величиной для данного вида ионов и зависит только от природы растворителя и температуры. Предельные эквивалентные электропроводности ионов являются справочными величинами. Отношение эквивалентной электропроводности раствора сильного электролита к ее предельному значению l∞ называют коэффициентом электропроводности (эту величину еще называют «кажущейся степенью диссоциации»)
Отношение эквивалентной электропроводности раствора слабого электролита к ее предельному значению l∞ представляет собой степень диссоциации:
Эквивалентная электропроводность растворов электролитов зависит от двух факторов: от степени диссоциации электролита и от электрического взаимодействия между ионами. В случае сильного электролита a = 1. Изменение эквивалентной электропроводности с концентрацией обусловлено коэффициентом электропроводности fl, т.е. влиянием электростатического взаимодействия ионов на скорость их движения. Изменение эквивалентной (и молярной) электропроводности сильных электролитов в зависимости от концентрации раствора объясняется электростатическим торможением ионов (торможением движения ионов в электрическом поле). С увеличением концентрации раствора ионы сближаются и электростатическое взаимодействие между ними возрастает. Это взаимодействие идет по двум каналам: электрофоретическому и релаксационному. Электрофоретический эффект заключается в том, что в водной среде все ионы гидратированы и под действием внешнего электрического поля движутся в разных направлениях. Таким образом, движение конкретного иона происходит как бы в среде ионов противоположного заряда, и эта среда движется в противоположном направлении. Релаксационный эффект связан с существованием ионной атмосферы и ее влиянием на движение ионов. При перемещении под действием внешнего электрического поля центральный ион выходит из центра ионной атмосферы, которая вновь создается в новом положении иона. С учетом релаксационного и электрофоретического эффектов
Электрофоретический эффект:
Релаксационный эффект:
Оба коэффициента зависят от природы растворителя и температуры. При небольших концентрациях зависимость эквивалентной электропроводности сильного электролита от концентрации выражается уравнением:
где а коэффициент, зависящий от природы растворителя и температуры; С – концентрация, экв/л. Уравнение было получено экспериментально Кольраушем, а впоследствии было теоретически выведено Дебаем, Хюккелем и Онзагером. При высоких концентрациях зависимость эквивалентной электропроводности от концентрации для бинарного электролита типа KI определяется уравнением Онзагера:
Для растворов слабых электролитов эквивалентная электропроводность зависит от концентрации электролита из-за изменения степени диссоциации. С увеличением концентрации электролита степень диссоциации уменьшается и увеличивается электростатическое взаимодействие между ионами. Это приводит к уменьшению эквивалентной электропроводности. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 544. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
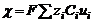
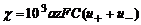

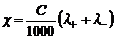
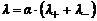 .
.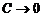 стремится к предельному значению
стремится к предельному значению 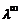 . Эта величина отвечает электропроводности гипотетического бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами.
. Эта величина отвечает электропроводности гипотетического бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами.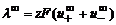 .
.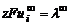 – предельная удельная электропроводность иона (Кольрауш). В этом случае:
– предельная удельная электропроводность иона (Кольрауш). В этом случае: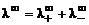
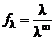
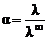
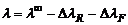
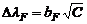
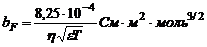
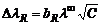
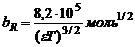
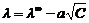 ,
,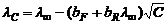 ,
,