
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
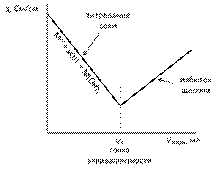
Кондуктометрический анализ растворовПрямая кондуктометрия Концентрация электролита может быть определена по электропроводности раствора, так как в определенных пределах возможна прямая пропорциональность между этими величинами. Метод широко используют для определения индивидуальных электролитов в растворе, для контроля процесса очистки воды, оценки загрязненности сточных вод, определяют степень чистоты неорганических или органических препаратов. Кондуктометрическое титрование Кондуктометрическое титрование используется при определении индивидуальных веществ и анализе разнообразных смесей. Точку эквивалентности при кондуктометрическом титровании определяют по изменению электропроводности раствора. электропроводность измеряют после каждой порции титранта. Зависимость электропроводности раствора от объема титранта изображают графически. Полученный график называют кривой кондуктометрического титрования. Кондуктометрические кривые имеют излом, соответствующий точке эквивалентности. Кривые титрования сильного электролита, как правило, имеют минимум на зависимости электропроводности от объема титранта. Наличие минимума связано с образованием слабого электролита, например воды, или мало растворимого вещества, например осадка гидроксида металла. Такой же вид кривая кондуктометрического титрования имеет при протекании аналитической реакции осаждения, например при титровании солей галогенидов нитратом серебра
Кривые кондуктометрического титрования: сильной кислоты щелочью, соли слабого основания щелочью и хлорида натрия нитратом серебра (осадительное титрование).  При титровании слабых электролитов кривая титрования рост электропроводности при увеличении объема титранта с перегибом в точке эквивалентности. Рост электропроводности раствора на первом участке кривой титрования связан с увеличением количества ионов по мере нейтрализации слабого электролита.
При реализации окислительно-восстановительного или комплексонометрического варианта титрования с применением кондуктометра кривая титрования выходит на значение электпропроводности, близкое к const. Метод кондуктометрического титрования позволяет анализировать смесь двух и более электролитов. При этом число перегибов на кривой титрования соответствует количеству точек эквивалентности.
К преимуществам метода кондуктометрического титрования относится возможность дифференцированного определения веществ в многокомпонентных смесях в водных растворах. Другим преимуществом метода является возможность определений в окрашенных и мутных растворах, а также в присутствии окислителей и восстановителей, ограничивающих применение других методов. Потенциометрические методы количественного анализа Теоретические основы метода Электродные потенциалы Вся группа потенциометрических методов определения основана не том, что электрохимический потенциал электрода является функцией активности компонентов соответствующих окислительно-восстановительных систем. Электрохимический потенциал возникает на границе электрод – раствор. Причиной образования электродного потенциала является появление на поверхности электрода двойного электрического слоя. Этот двойной электрический слой можно сравнить с плоским конденсатором, одной обкладкой которого служит заряженная поверхность металла, а другой – внешняя граница ДЭС. К сожалению, непосредственно измерить потенциал какой-либо системы пока не представляется возможным. Мы можем измерить только разность потенциалов или ЭДС гальванической системы, состоящей из пары электродов. В связи с этим было введено понятие водородного электрода и шкалы стандартных электродных потенциалов. Потенциал водородного электрода условно принят равным нулю и относительно него были измерены потенциалы всех возможных электродных систем. В силу того, что потенциал электрода зависит от температуры и концентрации раствора было принято привести значения электродных потенциалов к единым условиям, получивших название стандартных: температура 298 K и концентрация раствора 1 моль/кг (если речь идет о газовых электродных системах, то давление 1 атм). Зависимость потенциала электрода от температуры и состава раствора описывается при помощи уравнения Нернста:
где z – число электронов в электродной реакции, z = y – x. Типы электродов Всего можно выделить 4 типа электродных систем. 1. Электроды 1 рода. Этот тип электродов образован простым веществом (металлом или неметаллом), погруженным в раствор своей соли. Металлическому электроду Ме|Меz+ соответствует реакция Меz+ + ze®Me и потенциал электрода описывается уравнением:
Неметаллическому электроду A|Az- соответствует электродная реакция A + ze ® Az- и потенциал электрода описывается уравнением:
Потенциал электрода первого рода зависит от активности лишь одного сорта ионов. 2. Электроды 2 рода. Такие электроды состоят из металла, покрытого слоем своей малорастворимой соли и погруженного в раствор, содержащий одноименные с этой солью анионы. Примером электрода второго рода может служить хлорсеребряный электрод, Ag, AgCl|KCl, потенциал которого зависит от содержания ионов Cl- в растворе. Однако, хлорсеребряный электрод нередко используют в качестве электрода сравнения при потенциометрических измерениях. В этом случае приэлектродное пространство заполняют насыщенным раствором хлорида калия, что обеспечивает стабильность значения электродного потенциала.
3. Газовые электроды состоят из инертного металла (Pt), контактирующего с газом и с раствором, содержащим одноименные с газом ионы. Самый известный пример газового электрода – водородный электрод: H+|H2,Pt. Для этого электрода реализуется реакция: H+ + e = 1/2H2, для которой уравнение Нернста:
или
4. Окислительно-восстановительные электроды. Такая система состоит из компонентов, находящихся в растворе. В этом случае индикаторным электродом служит инертный металл (обычно платина или золото), который не принимает участия в реакции, а служит лишь передатчиком электронов между компонентами окислительно-восстановительной системы, поэтому только последние определяют величину потенциала электрода. Примером может служить платина, погруженная в раствор, содержащий Fe2+ и Fe3+. Pt | Fe2+, Fe3+ В этом случае на электроде протекает реакция Fe3+ + е = Fe2+, потенциал которой будет определяться уравнением:
В настоящее время все большее применение получают мембранные электроды, которые представляют собой тонкую мембрану, способную обмениваться с раствором ионами. Вследствие такого обмена на границе «мембрана – раствор» устанавливается потенциал, зависящий от концентрации обмениваемых ионов в растворе. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 578. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |






 ,
, .
. .
.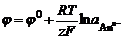 .
.
 .
.