
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Экстракция органическими кислотами и их солямиПротекает по катионообменному механизму, извлекаются положительно заряженные ионы металла. Классический вариант описания процессов экстракции карбоновыми кислотами предусматривает существование молекулы экстрагента в органической фазе в виде недиссоциированного димера
для которого уравнение эффективной константы равновесия
С учетом того, что коэффициент распределения катиона металла в органическую фазу
или в логарифмической форме
где в величину При катионообменной экстракции неорганические анионы не переходят в органическую фазу. Тем не менее, природа аниона минеральной кислоты в водной фазе влияет на ход зависимости lgD = f(pH). Это связано с различной способностью катионов к комплексообразованию в водной фазе с разными анионами. Образование комплексов с неорганическими лигандами в водной фазе предлагается учитывать преобразованием уравнения константы равновесия к виду
или в логарифмической форме
где Линейный ход зависимости коэффициента распределения от рНпозволил ввести понятие рН полуэкстракции, позволяющее оценить экстракционную способность данного экстрагента по отношению к различным катионам металлов. рН полуэкстракции (рН1/2) – равновесное значение рН, при котором степень экстракции составляет 50 % при равных объемах органической и водной фаз и коэффициенте распределения D = 1.  На основании значений рН1/2, вычисленных по уравнению
в котором Наиболее хорошо экстрагируются трехзарядные катионы, за ними следуют двухзарядные, завершают ряд однозарядные. По мере усиления основных свойств металла его экстрагируемость катионообменными экстрагентами ухудшается. Электрохимические методы анализа Общая краткая характеристика методов К электрохимическим будем относить процессы, сопровождающиеся переносом заряда, образованием двойного электрического слоя и идущие на поверхности раздела фаз. Такой комплекс процессов, как правило, сопровождается взаимным превращением электрической энергии в химическую в результате протекания окислительно-восстановительных реакций. Электрохимические методы анализа основаны на использовании законов прохождения тока для аналитических целей. Самыми распространенными на сегодняшний момент способами электрохимического анализа состава вещества являются кондуктометрические и потенциометрические группы методов. Не так давно конкуренцию этим двум методам составляла полярография, но необходимость работать с металлической ртутью сделала этот, в общем-то, неплохой и точный метод анализа, методом второго плана. Кондуктометрия Теоретические основы метода. Электропроводность растворов электролитов Виды элетропроводности Как и все проводники, растворы электролитов характеризуются определенным сопротивлением. Величина, обратная сопротивлению, называется электропроводностью:
где R – сопротивление раствора, Ом; W – электропроводность раствора, Ом-1. Анализ растворов, основанный на измерении электропроводности, называется кондуктометрическим анализом. В основе экспериментального исследования явлений электропроводности лежит измерение величины удельного сопротивления раствора ρ, связанного с удельной электропроводностью:
Удельная электропроводность является функцией природы электролита, его концентрации, природы растворителя и температуры. В широком диапазоне концентраций удельная электропроводность проходит через максимум практически для всех электролитов. В разбавленных растворах (при концентрации C < 10−2 – 10−3 моль/л) наблюдается полное единообразие ‒ удельная электропроводность почти линейна по концентрации. Однако в концентрированных растворах, особенно в неводных растворах, такого единообразия не наблюдается. Для выполнения физико-химических расчетов, например, определения констант диссоциации или расчета растворимости по данным измерения электропроводности раствора применяют величины, производные от удельной электропроводности – молярную и эквивалентную электропроводность. Молярная электропроводность представляет собой отношение удельной электропроводности к концентрации электролита в 1 м3:
Если концентрация выражена в молях на литр, то в числителе следует ставить множитель 10-3:
Значительно чаще используют эквивалентную электропроводность, поскольку она исключает влияние заряда иона:
где z - число эквивалентов в 1 моле. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 490. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 , иона металла в водной фазе – в виде простого гидратированного катиона
, иона металла в водной фазе – в виде простого гидратированного катиона  :
: ,
,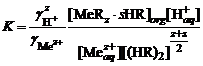 .
. ,
,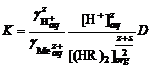
 ,
,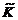 введен коэффициент активности катиона металла.
введен коэффициент активности катиона металла.
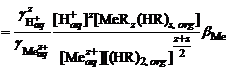
 ,
, – равновесная концентрация металла в водной фазе в форме простого катиона;
– равновесная концентрация металла в водной фазе в форме простого катиона; 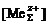 – аналитическая концентрация металла в водной фазе;
– аналитическая концентрация металла в водной фазе;  – константа нестойкости комплекса металла с неорганическим лигандом.
– константа нестойкости комплекса металла с неорганическим лигандом. ,
, .
.
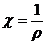 , Ом‒1см‒1
, Ом‒1см‒1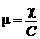
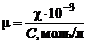
 ,
,