
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Экстракция за счет химического взаимодействияДанный процесс сопровождается образованием сложных комплексных соединений экстрагируемого вещества с органическим компонентом. Эффективность разделения определяется прочностью комплексов, образуемых компонентами. Данный метод в основном используется для разделения металлов. Здесь экстрагент – органический раствор экстракционного реагента, способного к образованию химических соединений с ионами или молекулами извлекаемого вещества, в инертном разбавителе (органическом растворителе). Образующееся химическое соединение должно быть нерастворимо в воде и хорошо растворяться в выбранном органическом растворителе. Молекула экстракционного реагента должна иметь гетерополярное строение и состоять из неполярного углеводородного радикала и полярной функциональной группы. Углеводородный радикал обеспечивает малую растворимость в воде и высокую растворимость в разбавителе, а функциональная группа – образование химической связи с целевым компонентом. В качестве разбавителей обычно применяют ароматические или алифатические углеводороды, хлорпроизводные углеводородов, спирты, нитробензол и др. Основное назначение разбавителя – снижение вязкости органической фазы, уменьшение потерь экстрагента. Однако в ряде случаев влияние разбавителя проявляется и в достижении более высокой степени извлечения и разделения компонентов водного раствора. В некоторых случаях функции разбавителя выполняет сам экстракционный реагент (характерно, например, для карбоновых кислот). Различие в способе экстракции проявляется в физических изменениях, наблюдаемых во время экстракции, а также в способе регенерации экстрагента.  В системах с физическим распределением относительная растворимость двух фаз обычно является функцией концентрации растворенного вещества. С другой стороны, когда образуется определенное химическое соединение, начальные растворимости двух растворителей друг в друге обычно почти не изменяются. Регенерация экстрагента Когда экстракция происходит в результате химического взаимодействиярастворенного вещества с растворителем, для последующей регенерации экстрагента (реэкстракции) требуется разрушение комплекса, осуществляемое химическим путем. В случае экстракции, основанной на физическом распределении, разделение растворенного вещества и растворителя достигается физическими способами, обычно перегонкой или дистилляцией. Стадия регенерации экстрагента может составлять существенную долю общей экономики процесса, включающую стоимость химических реагентов и затраты тепловой энергии. Данная стадия заслуживает особого внимания при проектировании экстракционного процесса, т.к. часто содержит ключ к решению вопроса об экономичности и неэкономичности процесса. При классификации экстракционных систем по типу экстрагентаобычно опираются на традиционную классификацию: 1) нейтральные экстрагенты – органические вещества, молекулы которых способны к образованию координационных связей с извлекаемым ионом; 2) жидкие ионообменники – органические кислоты и их соли или органические основания и их соли, способные к обмену неорганического иона, входящего в состав экстрагента на ион, находящийся в водном растворе.
При классификации по форме существования извлекаемого компонента можно обозначить две ситуации. 1. Экстрагируемое соединение уже существует в водной фазе – тогда мы чаще всего имеем дело с физическим распределением вещества и нужен только органический разбавитель. 2. Экстрагируемое соединение в водной фазе не существует и образуется непосредственно в процессе экстракции за счет химического взаимодействия с органическим реагентом. Так, например, происходит экстракция с образованием хелатов или ионных ассоциатов. Высаливатель Как правило, инертное вещество (соль) способствующее переходу целевого компонента в органическую фазу, за счет образования мощных гидратных структур. Наибольшее высаливающее действие оказывают ионы с большой склонностью к гидратации. Наиболее сильно гидратируются ионы с малым радиусом и большим зарядом, например, Li+, Mg2+, Al3+. Разбавители Разбавители бывают двух типов: инертные и активные. Инертные разбавители мало или вообще не взаимодействуют с экстрагируемым веществом (углеводороды, хлорпроизводные). Активные разбавители реагируют с извлекаемым компонентом с образованием сольватов. Данный процесс, как правило, улучшает показатели процесса экстракции. Молекулы активных разбавителей как правило содержат в своем составе кислород. 6.2.3.4. Требования к экстрагентам: · избирательность по отношению к целевому компоненту; · высокая экстракционная емкость по извлекаемому компоненту; · легко осуществляемая реэкстракция компонента; · хорошее разделение фаз, для чего необходима значительная разница в плотности; · низкая вязкость; · безопасность – экстрагент не должен быть токсичным, взрывоопасным, летучим; · устойчивость во время хранения и при сооприкосносении с кислотами или щелочами, т.е. во время экстракции не должно происходить гидролиза, полимеризации и др.; · низкая стоимость и доступность. Термодинамика экстракционных процессов Общие положения На практике для описания экстракционных процессов прибегают к эффективной или исправленной константе равновесия. В уравнении эффективной константы равновесия учтена неидеальность водной фазы через произведение коэффициентов активности, однако для характеристики содержания элемента в органической фазе используется понятие концентрации, поскольку определение активности компонента в многокомпонентной органической системе затруднительно, а в большинстве случаев вовсе невозможно. Помимо эффективной константы равновесия для описания экстракционных равновесий используют понятие концентрационной (кажущейся) константы равновесия. Однако применение эффективной константы равновесия представляется более рациональным для описания поведения элементов в растворах сложного ионного состава. При описании термодинамических закономерностей экстракционных равновесий и установлении коэффициентов уравнения реакции экстракции широко применяется анализ угловых коэффициентов, или slop-анализ, предложенный А.С. Соловкиным. В методе slop-анализа используется принцип линеаризации уравнения эффективной константы равновесия путем логарифмирования и замещения в уравнении эффективной константы соотношения концентрации металла в органической и водной фазах коэффициентом распределения. В самом общем случае уравнение взаимосвязи коэффициента распределения и константы равновесия можно записать следующим образом:
где в величину Основу slop-анализа составляет экспериментальная зависимость коэффициента распределения от переменных уравнения, т.е. от концентрации экстрагента, аниона-лиганда, значения рН. Угловые коэффициенты логарифмических зависимостей коэффициента распределения от переменных уравнения соответствуют стехиометрическим коэффициентам экстракционного равновесия; линейный член – константе равновесия. Величина углового коэффициента линейной зависимости логарифма коэффициента распределения от обратной температуры позволяет вычислить тепловой эффект реакции экстракции:
где С – константа. Изменение энтропии реакции экстракции вычисляется по уравнению
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 434. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 ,
, включено произведение коэффициентов активностей,
включено произведение коэффициентов активностей,  ;
;  – концентрация экстрагента;
– концентрация экстрагента;  - концентрация аниона-лиганда.
- концентрация аниона-лиганда.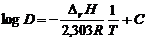 ,
, .
.