Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Количественное определение.Точную навеску предварительно высушенного эпинефрина (0,3 г) растворяют в 50 мл ледяной уксусной кислоты и титруют 0,1 моль/л хлорной кислотой, добавив 2 капли раствора кристаллического фиолетового. 1 мл 0,1 моль/л HClO4 эквивалентен 18,321 мг C9H13NO3. Контрольные вопросы и задания • Какие функциональные группы и заместители содержатся в молекулах аминоспиртов - эфедрина и эпинефрина? • Приведите структурную формулу природного алкалоида - левовращающего эритро-изомера эфедрина. • Запишите реакцию окисления эфедрина до бензальдегида (фармакопейная реакция подлинности). • Какие спектральные методы определения подлинности эфедрина описаны в ЕФ? • Какой метод используют для количественного определения эфедрина в ЕФ? • Что означает заключительная фраза при описании методики количественного определения эфедрина гидрохлорида: «1 мл 0,1 моль/л HClO4 эквивалентен 20,17 мг C10H16ClNO»? • Докажите, что в отличие от эфедрина эпинефрин (адреналин) проявляет свойства амфолитов. • Приведите специфические реакции подлинности эпинефрина.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ Фенолы Фенолы - производные ароматических углеводородов, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы. Строение и свойства По числу фенольных гидроксильных групп в ароматическом кольце различают одноатомные и многоатомные фенолы:
Фенольный гидроксил находится в р,л-сопряжении с ароматическим кольцом. Это приводит к снижению электронной плотности на атоме кислорода, в результате чего протон становится более подвижным и кислотные свойства фенолов увеличиваются по сравнению со спиртами. Электронодонорное влияние фенольного гидроксила приводит к увеличению электронной плотности ароматического кольца в орто- и пара-положениях: 
Это облегчает протекание реакций электрофильного замещения и окисления. Например, фенол бромируется избытком бромной воды в орто- и пара-положения при комнатной температуре при отсутствии катализатора. Для проведения этой реакции к 1% раствору фенола добавляют бромную воду. Образующееся бромпроизводное выпадает в осадок:
Фенолы, имеющие по сравнению с аренами повышенную электронную плотность в кольце, легко окисляются. Окисление фенола приводит к образованию n-бензохинона:
Получение Фенол и его гомологи выделяют из продуктов переработки каменного угля и нефти. В основе получения фенолов лежат реакции введения гидроксильной группы в ароматическое кольцо. Например, резорцин может быть получен сплавлением м-бензолдисульфокислоты с гидроксидом натрия с последующей нейтрализацией раствором хлороводородной кислоты:
Полученный резорцин экстрагируют органическими растворителями и отгоняют под вакуумом. Механизмы действия и биотрансформация. Фенолы используют как антисептические средства (см. табл. 10.7). Их антисептическое и бактерицидное действие связано со способностью вызывать денатурацию белков микроорганизмов.
Таблица 10.7. Лекарственные средства фенолов
Сила антисептического действия фенолов зависит от структуры их молекулы. Введение в молекулу фенола таких заместителей, как алкил, алкоксил, галоген, приводит к усилению бактерицидной активности. Увеличение длины алкильного радикала усиливает антисептическое действие фенола. При введении в молекулу фенола второго гидроксила увеличивается токсичность соединения. Контроль качества Определение подлинности Для идентификации фенолов проводят индофеноловую реакцию. Для этого растворяют 0,5 г фенола в 2 мл 13,5 моль/л раствора аммиака. Раствор должен оставаться прозрачным. Затем этим же раствором аммиака доводят объем до метки в мерной колбе на 100 мл. К 2 мл полученного раствора добавляют окислитель, например 0,05 мл раствора гипохлорита натрия или кальция, и оставляют раствор при комнатной температуре. Появляется темносинее окрашивание. При добавлении окислителя образуется хинон, который при взаимодействии с аммиаком превращается в хинонимин, вступающий в реакцию с непрореагировавшим фенолом:
Фенол реагирует с 4-аминоантипирином в щелочной среде в присутствии окисляющих агентов с образованием соединения красно-фиолетового цвета:
С азотистой кислотой протекает реакция нитрозирования фенола. Эта реакция характерна для тех фенолов, у которых нет заместителей в о- и я-положениях. Образующийся я-нитрозофенол изомеризуется в оксим я-бензохинона:
Оксим n-бензохинона, реагируя с избытком фенола в кислой среде, дает окрашенный индофенол Аналогично идет реакция, если в качестве реагента взять готовый n-нитрозофенол, например бледно-желтый раствор 5-нитрозо8-гидроксихинолина в концентрированной серной кислоте. Оксимная форма его реагирует с фенолом с образованием соответствующего индофенола:
Из реакций замещения, характерных для фенолов, в анализе используется реакция нитрования. При действии на фенол разведенной азотной кислоты образуются нитрофенолы, которые могут существовать в двух таутомерных формах. Образование хиноидной формы (ациформы) обусловливает окраску (обычно желтую).
Для фенолов со свободным n-положением характерна также реакция конденсации с 4-хлоримин-2,6-дихлорхиноном, в результате которой образуются окрашенные индофенолы, являющиеся кислотно-щелочными индикаторами:
Индофенолы этого типа обычно окрашены в коричневый или желтый цвет, а их щелочные и аммонийные соли синего цвета. Среди разнообразных хромогенных реакций электрофильного замещения в орто- или пара-положении в молекуле фенола часто используется реакция фенолов с солью диазония в щелочной среде. Реакция очень чувствительная и дает возможность открывать фенолы в весьма малых количествах. В качестве реактива обычно используют 0,1% раствор сульфаниловой кислоты и 1% раствор нитрита натрия в кислой среде. Образующаяся соль диазония при добавлении фенола и нескольких капель аммиака дает красное окрашивание (азокраситель):
При реакции С-алкилирования фенолов формальдегидом в щелочной среде образуются орто- и пара-замещенные гидроксиметилированные фенолы:
Благодаря продукту, имеющему хиноидное строение, раствор окрашивается в розово-красный цвет, что может быть использовано в фармацевтическом анализе. При стоянии раствор становится бурым вследствие дальнейшего процесса конденсации, приводящего к образованию полимерных продуктов. Фенолы образуют окрашенные соединения с солями железа (Ш):
Окраска продуктов реакции зависит от присутствия в бензольном ядре других функциональных групп. Например, в зависимости от числа и расположения фенольных гидроксилов в ядре окраска изменяется следующим образом: одноатомный фенол дает синефиолетовое окрашивание, двухатомные фенолы - пирокатехин - зеленое, резорцин - синее, гидрохинон - зеленое, переходящее в желтое. Все описанные выше реакции являются общими для фенолов. Однако имеются и специфические реакции, характеризующие индивидуальность того или другого фенола. Определение подлинности резорцина проводят методом ИК-спектроскопии относительно стандартного образца, используя в качестве растворителя абсолютный спирт. При нагревании раствора резорцина с раствором натрия гидроксида (10 моль/л) в присутствии нескольких капель хлороформа появляется интенсивное красное окрашивание:
Специфической реакцией на резорцин, отличающей его от всех других фенолов, является реакция сплавления его со фталевым ангидридом в присутствии концентрированной H2SO4 с образованием флуоресцеина - желто-красный раствор имеет зеленую флуоресценцию. Испытания на чистоту Раствор резорцина (2,5 г в 25 мл воды) должен быть прозрачным и окраска должна соответствовать окраске эталона. Эти характеристики должны сохраняться при нагревании раствора на водяной бане в течение 5 мин. Родственные примеси определяют методом хроматографии в тонком слое. Потеря в массе при высушивании не должна быть выше 1,0%, сульфатная зола - не более 0,1%. Оценку кислотности проводят индикаторным методом. Количественное определение Для количественного определения резорцина растворяют 0,500 г субстанции в воде и доводят объем до 250,0 мл. К 25,0 мл раствора добавляют 1,0 г раствора KBr, 50,0 мл 0,0167 моль/л раствора KBrO3, 15 мл хлороформа и 15,0 мл хлороводородной кислоты. Закрывают колбу, встряхивают ее и оставляют в темном месте на 15 мин, пере- мешивая время от времени. При этом протекает бромирование в ароматическое кольцо. Затем добавляют 10 мл 100 г/л раствора KI, энергично встряхивают и оставляют на 5 мин. Избыток брома окисляет йодид до молекулярного йода: Br2 + 2KI → I2 + 2KBr Затем титруют выделившийся йод 0,1 моль/л раствором натрия тиосульфата с 1 мл раствора крахмала в качестве индикатора. I2 + 2Na2S2O3 → 2NaI + Na2S4O6 1 мл 0,0167 моль/л раствора KBrO3 эквивалентен 1,835 мг C6H6O2. Контрольные вопросы и задания • Какие функциональные группы содержатся в фенолах? Чем отличаются одно- и многоатомные фенолы? • Каков механизм индофеноловой реакции - фармакопейной реакции определения подлинности фенола? • Что такое реакция нитрозирования? • В каком положении будет происходить замещение при нитровании? • Запишите реакцию сочетания фенола с солью диазония. • Покажите, что комплекс фенола с ионом железа (Ш) имеет октаэдрическое строение. • Перечислите специфические реакции подлинности на резорцин. • В чем сущность метода количественного определения резорцина? Таблица 10.8 Лекарственные средства - производные ароматических карбоновых кислот
Окончание табл. 10.8
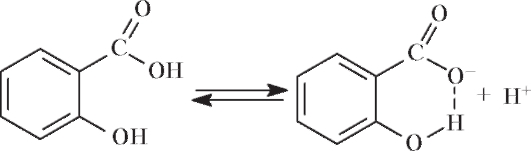
Ароматические карбоновые кислоты - соединения, в которых функциональной группой является карбоксильная группа -СООН, связанная с ароматическим бензольным кольцом. Первым и простейшим представителем ароматических кислот является бензойная С6Н5СООН. Ортогидроксипроизводное бензойной кислоты - салициловая кислота. Салициловая кислота (рКа = 2,98) гораздо сильнее бензойной (рКа = 4,19), так как образующийся при диссоциации салицилат-ион стабилизирован внутримолекулярной водородной связью:
Обе кислоты оказывают губительное действие на микроорганизмы и в качестве антисептиков применяются в фармации. Производные бензойной и салициловой кислот - соли, амиды, сложные и простые эфиры - также проявляют фармакологическую активность и применяются в медицине. Строение и свойства
В молекуле бензойной кислоты выделяют следующие реакционные центры: --ОН - кислотный центр (карбоксильная группа), за счет которого бензойная кислота проявляет кислотные свойства в реакциях с основаниями, например при получении натриевой соли - бензоата натрия; - электрофильный центр - атом углерода карбоксильной группы, обусловливающий реакции нуклеофильного замещения (например, образование эфиров). Получение В промышленности бензойную кислоту получают окислением толуола кислородом воздуха при 130-160 °С, давлении 308-790 кПа и в присутствии катализаторов - солей кобальта и марганца или оксида ванадия(V). Бензойную кислоту можно получить также окислением толуола сильными окислителями, например диоксидом марганца:
Натриевую соль бензойной кислоты получают, выпаривая досуха раствор кислоты, нейтрализованный эквивалентным количеством водородкарбоната или карбоната натрия:
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 1411. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |