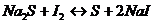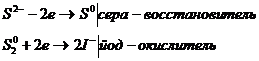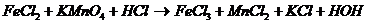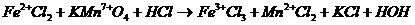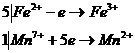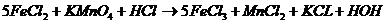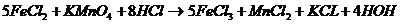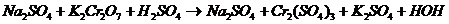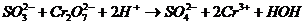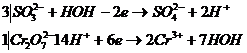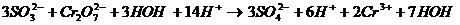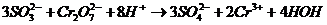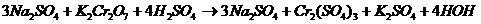Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Окислительно-восстановительные реакцииПри изучении окислительно-восстановительных реакций важно усвоить суть этих реакций с точки зрения электронной теории, подбор коэффициентов в уравнениях окислительно-восстановительных реакций, а также значение окислительно-восстановительных реакций в аналитической химии, в частности в методе оксидиметрии. Окислительно-восстановительные реакции протекают с переходом электронов от одного иона или атома к другому. Восстановитель отдаёт электроны, а окислитель принимает в процессе реакции, причём оба процесса протекают одновременно. Например Составим электронные уравнения:
Окислителями могут быть нейтральные атомы – хлор, бром, йод, соединения: KMnO4, K2Cr2O7, H2O2, HNO3 И др. В качестве восстановителей применяют металлический Zn, Fe, тиосульфат натрия Na2S2O3, углерод C, ионы металлов переменной валентности и низшей степени окисления Fe2+, Sn2+, Cr3+ и др.
Подбор коэффициентов в ОВР Применяют два метода: Метод электронного баланса – уравнивают число отданных и присоединённых электронов. Пример 2.2.1.
Определяем степени окисления восстановителя и окислителя до и после реакции:
Составляем электронные уравнения, находим коэффициенты
Подставляем найденные коэффициенты 1 и 5 перед восстановителем и окислителем до и после реакции (коэффициент 1 опускаем)
Теперь надо добавить коэффициенты согласно закону сохранения массы (баланс атомов)
Ионно-электронный метод предусматривает раздельное составление ионных уравнений для процесса окисления и восстановления с последующим суммированием их в общее ионное уравнение Пример2.2.2. Составить уравнение реакции окисления-восстановления. 
Пишем схему реакций в ионной форме
Составляем электронно-ионные уравнения
Суммируем электронно-ионные уравнения
Сократив подобные члены, находим ионное уравнение
По этому ионному уравнению можно составить молекулярное уравнение реакции
Вопросы №51-56 контрольной работы 1 рассчитаны на знание данной темы. Литература:[3], с. 114-124;[10], раздел 1;[7],с. 32-35;[8],с.22-25.
|
||
|
Последнее изменение этой страницы: 2018-05-31; просмотров: 190. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |