
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Методов анализа химического составаВ аналитически контроле на металлургическом производстве используют различные методы анализа, которые наиболее правильно отражают химический состав материала. Эти методы анализа заранее разрабатывают в специальных лабораториях научно-исследовательских институтов отбирают по точности, скорости выполнения и другим чисто практическим качествам. Проверяют на массовых анализах в условиях заводских лабораторий. Затем эти, так называемые унифицированные (единообразные) метод» сводят в специальные сборники стандартизованных методов анализа (сборники ГОСТов) в зависимости от объекта анализируют. (руда, шлак, чугун, сталь и т.д.). Более подробно изучить терминологию, сущность методов анализа, применяемых в контроле металлургического производства, можно в литературе [5], с. 6- 12. Вопросы, связанные с отбором и подготовкой проб к анализу, излагаются также а литературе Г&],с»19-45}[8],глава Ш.1У, В контрольной работе I к денной тепе относятся вопросы 87-37.
2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ АНАЛИТИЧЕСКОЙ ХИМИИ 2.1. Химическое равновесие и теория электролитической диссоциации В этой теме рассматриваются вопросы, которые тесно связан» с курсом предмета «Основы физической химии» а именно: равновесие в однородной системе, скорость химической реакции и ее выражение, закон действующих масс, константа химического равновесия, сдвиг равновесия. Кроме этого, рассматриваются вопросы, изученные в курсе "Общая химия", а именно: электролитическая диссоциация, электролиты, степень и константа электролитической диссоциации. Равновесие в насыщенных растворах, ПР. Электролитическая диссоциация воды, ионное произведение воды, водородный и гидроксильный показатели, буферные растворы и их применение. Двойные соли и комплексные соединения.  Зависимость скорости реакции от концентрации (при T=const) выражается законом действия масс. Например, для обратимой реакции, записанной в общем виде уравнением: Скорость прямой реакции составляет
где [A],[B] - концентрации веществ А и В, моль/л, Аналогично, скорость обратной реакции:
где[С],[D]- концентрации веществ C и D моль/л. При достижении равновесия: Следовательно,
Преобразуя это уравнение и заменив отношение
где К - константа химического равновесия Формуле константы скроет отражает для обратимых реакции. Пользуясь этим законом можно управлять состоянием химического равновесия. Основные положения теория электролитической диссоциации: I. Многие вещества под влиянием полярных молекул воды распадаются на ионы:
Такой процесс называется электролитической диссоциацией вещества, способные к диссоциации - электролитами. 2. Способность электролитов распадаться на ионы выражают через степень электролитической диссоциации α – отношение числа диссоциированных молекул к общему числу молекул в растворе, т.е.
Например: α= 0, 15 - это означает. что на ионы распадалось 15% или 15 молекул из 100. Процесс диссоциации обратимый.
Применим закон действующих масс как к обратимой реакции
где С - концентрация раствора уксусной кислоты.
Для слабых электролитов от α< 0, 01, поэтому в знаменателе α можно пренебречь. Тогда
Даже чистая вода обладав; некоторой электропроводностью и, хоть незначительно, распадается на ионы:
Определим константу равновесия этой реакции:
Отсюда В нейтральной среде Удобнее концентрацию ионов водорода выражать водородным показателем рН, а концентрацию гидроксильных ионов – гидроксильным показателем рОН. -
В кислой среде рН < 7; щелочной рН > 7. Чем выше значение рН. тем сильнее выражена щелочность раствора и наоборот, но сумма значений рН и рОН постоянна, равна 14. В аналитической практике приходится работать с осадками, Известно, что абсолютно нерастворимых веществ в природе не существует, поэтому любой о се до к, хоть и незначительно, растворяется на ионы, например
Мерой растворимости осадка служит произведение растворимости, сокращенно ПР. Применяя закон действующих масс к данному равновесию, получим:
При установившемся равновесии в насыщенном растворе трудно-растворимого электролита произведение концентраций его ионов при денной температуре есть величина постоянная, называемая произведением растворимости. Пример 2.1.1. Как изменится скорость прямой реакции 2А + В = С, если концентрация А и В увеличится в два раза? Решение Скорость реакции найдем из Формулы (2.1) Скорость реакции Найдем измерение скорости, т.е.
Следовательно, скорость прямой реакции увеличилась в 16 раз, Пример 2.1,2. Вычислить степень диссоциации 1,028 М раствора гидрооксида аммония, если концентрация ОН-ионов в нем 4,112-10'*3г-ион/л'>. Решение Уравнение диссоциации: Выражение 1,028М означает, что в одном литре данного раствора содержится 1,028 молей NH4OH. Такой способ выражения концентрации называется молярностью или молярной концентрацией. Для расчёта степени диссоциации применим формулу 2.2
Пример 2.1.3. Вычислить рОН раствора, содержащего ионы водорода в количестве Решение Из формулы 2.4. находим значение рН
Вопросы контрольной работы 1 с №38 по №50. Литература: [3],с.27-46,76-78,96-105,129; [7],с.10-21,25-28;[8], с.25-41.
|
||
|
Последнее изменение этой страницы: 2018-05-31; просмотров: 181. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |


 - константа скорости реакции, а зависящая от природы реагирующих веществ и от температуры;
- константа скорости реакции, а зависящая от природы реагирующих веществ и от температуры;


 на К получим:
на К получим:

 (2.2)
(2.2) - уксусная кислота является слабый электролит, т.е. диссоциированы на ионы менее 3%
- уксусная кислота является слабый электролит, т.е. диссоциированы на ионы менее 3%
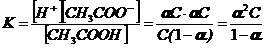

 (2.3)
(2.3)
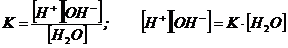
 величина постоянная, называемая ионным произведением воды, при комнатной температуре равна 10-14 .
величина постоянная, называемая ионным произведением воды, при комнатной температуре равна 10-14 . 10-14
10-14
 (2,4)
(2,4)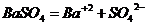

 При увеличен [2А];[2В] .
При увеличен [2А];[2В] .

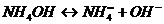
 , или 0,4%
, или 0,4% г-ион/л.
г-ион/л.
