
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Обработка результатов эксперимента1. Заполнить таблицу:
где СKSCN = 1 моль/л; 50 – объем мерной колбы, мл; VKSCN – берется из условий эксперимента, мл;
2. По данным таблицы построить 3 графика в координатах а) [Fe]общ/D = f([KCNS]-1), б) [Fe]общ/D = f([KCNS]-2), в) [Fe]общ/D = f([KCNS]-3). 3. Для каждого графика построить линию тренда (формат линии тренда: аппроксимация – линейная, показывать уравнение на диаграмме, поместить на диаграмму величину достоверности аппроксимации R2). 4. По уравнениям линий тренда для каждого из трех случаев вычислить значения констант нестойкости по формуле:
где a – линейный член уравнения линии тренда, b – угловой коэффициент уравнения линии тренда. 5. Вычислить изменение энергии Гиббса диссоциации роданидного комплекса железа по формуле:
6. Определить значение
где 7. Результаты вычислений по п.п. 4, 5, 6 занести в таблицу:
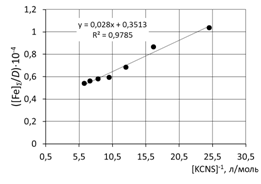
8. Сделать вывод об устойчивости роданидного комплекса железа на основании величины константы нестойкости и значения энергии Гиббса. 9. Сравнить полученные значения энергии Гиббса образования роданидных комплексов железа со справочными данными. Пример обработки экспериментальных данных как показано на рисунке.
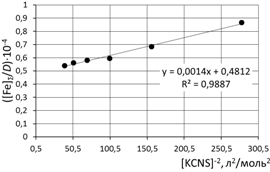
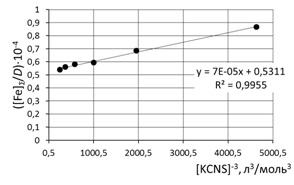
при обработке зависимости данные эксперимента использованы полностью
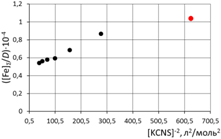
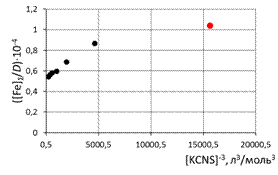
при обработке зависимостей первая экспериментальная точка (отмечена красным) удалена  а) [Fe]общ/D = f([KCNS]-1) Уравнение линии тренда: [Fe]общ/D = 0,028·[KCNS]-1 + 0,3513
б) [Fe]общ/D = f([KCNS]-2) Уравнение линии тренда: [Fe]общ/D = 1,4·10-3·[KCNS]-2 + 0,4812
в) [Fe]общ/D = f([KCNS]-3) Уравнение линии тренда: [Fe]общ/D = 3·10-5·[KCNS]-3 + 0,5851
Содержание отчета по лабораторной работе 1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. Лабораторная работа № 6. Кинетика окисления иодида калия персульфатом аммония Цель работы Определить константу скорости реакции окисления иодида персульфатом аммония при заданных начальных концентрациях реагентов. Сущность работы Реакция окисления иодида калия персульфатом аммония 2KI + (NH4)2S2O8 = I2 + K2SO4 + (NH4)2SO4 (или в ионной форме: Оборудование и реактивы Бюретка объемом 25 мл – 4 шт.; мерная пипетка объемом 5 мл (для крахмала) – 1 шт.; секундомер; колба круглая объемом 100 мл – 5 шт.; химический стакан объемом 50 мл – 5 шт; химический стакан объемом 25 мл (для персульфата) – 1 шт.; иодид калия – 0,2 М раствор; тиосульфат натрия – 0,02 М раствор; крахмал – 1 % раствор; персульфат аммония – 0,2 М раствор. Выполнение работы 1. В каждую из 5 колб при помощи маркированных бюреток отмерить порции растворов иодида калия, тиосульфата натрия и дистиллированную воду в количествах, указанных в таблице 1. Мерной пипеткой объемом 5 мл в каждую колбу отобрать порцию крахмала. Содержимое колб перемешать. 2. В маркированный химический стакан объемом 25 мл отмерить указанный объем персульфата, вылить в колбу с приготовленной реакционной смесью и одновременно включить секундомер. 3. При появлении синего окрашивания секундомер останавливают и записывают время опыта. 4. П.п. 2 и 3 выполнить для всех колб.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
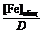 , моль/л
, моль/л
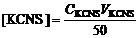 ,
, , моль/л.
, моль/л. ,
,
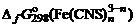 по формуле:
по формуле: ,
,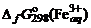 = –10,53 кДж/моль;
= –10,53 кДж/моль; 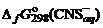 = +89,96 кДж/моль.
= +89,96 кДж/моль.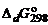 , кДж/моль
, кДж/моль
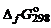 , кДж/моль
, кДж/моль
 ;
;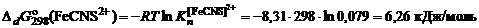
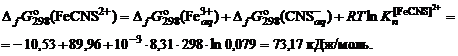
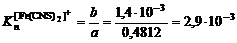 ;
;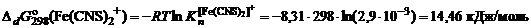
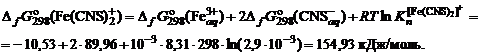
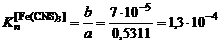 ;
;
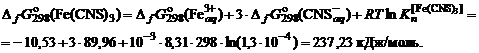
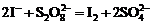 ) протекает с выделением йода по суммарному второму порядку (по первому порядку для каждого из компонентов). Лимитирующей стадией процесса является образование промежуточного продукта – иона иодсульфата:
) протекает с выделением йода по суммарному второму порядку (по первому порядку для каждого из компонентов). Лимитирующей стадией процесса является образование промежуточного продукта – иона иодсульфата: 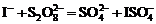 , который разлагается по реакции:
, который разлагается по реакции:  . Образование йода можно увидеть по посинению раствора крахмала. Крахмал является очень чувствительным реагентом на молекулярный йод. Поэтому даже при самой малой скорости реакции при сливании компонентов раствор быстро окрасится в синий цвет. Чтобы задержать появление окраски, в систему добавляется строго определенное количество тиосульфата натрия, который реагирует с выделяющимся йодом по реакции: I2 + 2Na2S2O3 = Na2S4O6 + 2NaI. Когда весь тиосульфат израсходуется, появляется синяя окраска крахмала. Время, необходимое для реакции тиосульфата может быть измерено по секундомеру.
. Образование йода можно увидеть по посинению раствора крахмала. Крахмал является очень чувствительным реагентом на молекулярный йод. Поэтому даже при самой малой скорости реакции при сливании компонентов раствор быстро окрасится в синий цвет. Чтобы задержать появление окраски, в систему добавляется строго определенное количество тиосульфата натрия, который реагирует с выделяющимся йодом по реакции: I2 + 2Na2S2O3 = Na2S4O6 + 2NaI. Когда весь тиосульфат израсходуется, появляется синяя окраска крахмала. Время, необходимое для реакции тиосульфата может быть измерено по секундомеру.