
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
I. Получение зависимости удельной электропроводности от содержания слабого электролита в растворе1. Приготовить серию из 4 последовательно разбавленных растворов слабого электролита: 1.1. Мерной пипеткой объемом 50 мл отобрать исходный раствор, поместить его в мерную колбу № 1 на 250 мл, довести до метки дистиллированной водой; закрыть колбу пробкой и перемешать раствор, переворачивая колбе не менее 40 раз; 1.2. Из колбы № 1 в колбу № 2 перенести при помощи мерной пипетки 50 мл раствора, довести объем в колбе № 2 дистиллированной водой до метки, закрыть колбу пробкой и перемешать раствор, переворачивая колбе не менее 40 раз; 1.3. Повторить с колбами № 3 и № 4. 2. Пробы приготовленных и исходного растворов отобрать в маркированные химические стаканы объемом 100 мл. 3. Измерить удельную электропроводность приготовленных растворов слабой кислоты путем погружения электрода кондуктометра в стакан с раствором. Начинать измерения следует с самого разбавленного раствора. При погружении электрода в раствор необходимо следить за тем, чтобы щель электрода была полностью закрыта раствором. При переходе от одного раствора к другому электрод следует насухо протереть кусочком фильтровальной бумаги. 4. Результаты измерений занести в таблицу 1. II. Анализ концентрации раствора слабой кислоты методом кондуктометрического титрования. 1. Получить от преподавателя раствор слабой кислоты. 2. Отобрать аликвоту 10 мл в химический стакан объемом 250 мл. 3. В бюретку залить раствор гидроксида натрия и «занулить» бюретку. 4. Поставить пробу на магнитную мешалку и поместить в раствор якорь магнитной мешалки. 5. Погрузить в стакан с пробой электрод кондуктометра. 6. Долить в стакан для титрования дистиллированную воду до закрытия щели электрода раствором.  7. Включить магнитную мешалку. 8. Зафиксировать показания кондуктометра. 9. Приливать гидроксид натрия из бюретки порциями по 1 мл, фиксируя после каждой порции щелочи значение электропроводности раствора. 10. Титрование продолжать до получения изменения хода зависимости удельной электропроводности от объема щелочи. 11. Данные занести в таблицу 2. Содержание протокола лабораторной работы 1. Название слабого электролита. 2. Химическая формула слабого электролита. 2. Ориентировочное значение концентрации слабого электролита (указано на емкости с этим электролитом) С0. 3. Концентрация раствора гидроксида натрия (титранта) СNaOH. Объем пробы слабого электролита, взятый для титрования Vа = _____ мл Таблица 1 - Зависимость удельной электропроводности от концентрации слабого электролита
Таблица 2 - Данные для построения кривой кондуктометрического титрования
*!!!!! Единицы измерения – см. на табло прибора!!!!!! Обработка экспериментальных данных I. Определение точного значения концентрации слабого электролита 1. По данным таблицы 1 построить кривую кондуктометрического титрования, которая будет иметь вид, показанный на рис. 4
Рис. 4. Экспериментальная кривая кондуктометрического титрования. 2. Обработать графически кривую титрования, как показано на рис. 5.
Рис. 5. Обработка экспериментальной кривой титрования и определение точки эквивалентности. 3. От места пересечения прямых опустить перпендикуляр с оси абсцисс и определить значение эквивалентного объема щелочи (см. рис. 3). 4. Точное значение концентрации слабого электролита вычислить по формуле:
где VЭ – эквивалентный объем щелочи, определенный по кривой титрования, мл; СNaOH – концентрация раствора щелочи, экв./л; Va – объем аликвоты слабого электролита, мл. II. Определение константы и степени диссоциации слабого электролита Далее в расчетах используется точное значение концентрации слабого электролита, определенное в п. I. 1. Вычислить эквивалентную электропроводность каждого раствора по формуле:
2. Заполнить таблицу:
3. По данным таблицы построить графики зависимостей c = f(C) и 1/λ = f(λС). 4. По графику 1/λ = f(λС) найти 1/λ∞ посредством экстраполяции зависимости на ось ординат 1/λ и вычислить λ∞. Полученное значение λ∞ сопоставить с данными [1]. При наличии сильного расхождения в дальнейших расчетах рекомендуется использовать справочные данные. 5. Рассчитать значение степени диссоциации по уравнению:
6. Вычислить значение константы диссоциации по уравнению:
7. Результаты вычислений занести в таблицу:
8. Среднее квадратичное отклонение σ рассчитывают по уравнению:
где t – коэффициент Стьюдента. Для доверительной вероятности 0,95·t = 3,2. 9. Окончательный результат представляют в виде: Kd = Kd среднее ± σ. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-30; просмотров: 337. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


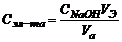 ,
, .
. .
. .
. ,
,