
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Техника безопасности при работе в лаборатории общей химииСтр 1 из 12Следующая ⇒ Содержание Введение................................................................................................................. 4 1 Лабораторная работа №1 Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание....................................................... 6 2 Лабораторная работа №2 Определение молярной массы химического эквивалента металла................ 20 3 Лабораторная работа №3 Основные классы неорганических соединений (часть I: оксиды, основные и амфотерные гидроксиды)...................................................................................................... 27 4 Лабораторная работа №4 Основные классы неорганических соединений (часть II: кислоты, соли)...... 34 5 Лабораторная работа №5 Кинетика химических реакций........................................................................ 40 6 Лабораторная работа №6 Исследование химического равновесия........................................................... 51 7 Лабораторная работа №7 Приготовление растворов заданной концентрации....................................... 59 8 Лабораторная работа №8 Малорастворимые электролиты. Произведение растворимости.................. 68 9 Лабораторная работа №9 Гидролиз солей................................................................................................. 74 10 Лабораторная работа №10 Изучение свойств буферных растворов потенциометрическим методом 11 Лабораторная работа №11 Коллоидно-дисперсные системы.................................................................... 91 12 Лабораторная работа №12 Окислительно-восстановительные реакции.................................................. 101 13 Лабораторная работа №13 Электрохимический ряд напряжений металлов. Коррозия металлов......... 109 14 Лабораторная работа №14  Жесткость воды, методы ее определение...................................................... 119 15 Лабораторная работа №15 Методы устранения жесткости воды............................................................. 129 Заключение.......................................................................................................... 134 Использованная литература............................................................................... 135 Введение
Настоящие методические указания составлены в соответствии c рабочей программой, полностью соответствующей ФГОС ВПО для бакалавров по направлению подготовки 280100 Природообустройство и водопользование. Они учитывают специфику данного направления подготовки и различный первоначальный уровень химических знаний студентов, а потому являются актуальными. Целью данной методической разработки является повышение эффективности преподавания химии для указанного направления подготовки бакалавров. Это достигается существенной методической и дидактической поддержкой самостоятельной работы студентов при подготовке к защите тем лабораторных работ. Настоящие методические указания наряду с методиками проведения опытов и обработки их результатов содержат методический материал, призванный помочь студенту в самоподготовке к защите тем лабораторных работ. Он включает теоретические пояснения к каждой работе, примеры решения типовых задач, перечень понятий и законов, которые должен знать студент, а также умений и навыков, которыми он должен обладать. В конце каждой лабораторной темы приводятся задания для самоконтроля и список рекомендуемой литературы. В ходе лабораторных работ студенты должны приобрести навыки самостоятельной экспериментальной работы, выполнения химических расчетов, работы со справочной химической литературой, научиться сопоставлять, анализировать и интерпретировать данные опытов и на этой основе делать логичные и обоснованные выводы и заключения. Для более эффективного использования времени аудиторных занятий предлагается заранее познакомиться с предстоящей работой, прочитав соответствующий раздел настоящих методических указаний, а при необходимости также конспекты лекций и определенные главы учебника. После выполнения опытов студенты защищают тему лабораторной работы. Для этого они должны: ˗ предъявить отчет о выполнении лабораторной работы, который оформляется в лабораторном журнале в соответствии с требованиями к форме и содержанию отчета; ˗ уметь изложить ход проведения лабораторных опытов, объяснить результаты эксперимента; ˗ по просьбе преподавателя составить соответствующие уравнения реакций, произвести расчеты, не выходящие за рамки типовых задач; ˗ показать удовлетворительные знания теоретических вопросов, не выходящих за рамки требований к уровню подготовки студентов (приводятся в методических указаниях для каждой лабораторной работы). Отчет должен содержать название и цель работы, краткий конспект теоретической части (по желанию), название опыта, сжатое описание методики эксперимента, уравнения реакций, наблюдаемые эффекты, ответы на все вопросы, поставленные в заданиях. Если на это есть указания, экспериментальные данные сводятся в таблицы. Расчеты определяемых величин приводятся полностью с необходимыми краткими пояснениями. При необходимости, полученные экспериментальные зависимости представляются в виде графиков. При построении графиков необходимо помнить следующее: - размер графика должен быть не меньше, чем половина тетрадного листа; - на осях координат через равные интервалы указываются единицы масштаба; - точки должны наноситься на график в соответствии с выбранным масштабом без нанесения дополнительных линий их координат и отметок на осях; - точки соединяются так, чтобы большинство из них попало на линию или было в одинаковой мере отдалено по обе стороны от нее. Отчет обязательно должен содержать выводы либо по всей работе, либо по отдельным ее частям.
1 Лабораторная работа №1 Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание
Цель работы: познакомить студентов с техникой безопасности при работе в лаборатории общей химии, правилами работы с химическими реактивами, назначением химической посуды и оборудования, правилами пользования ими, техникой нагревания, охлаждения, фильтрования, взвешивания.
Оборудование и реактивы: стеклянная (пробирки, стаканы, колбы, бюксы), фарфоровая (тигли, фарфоровые чашки, ступка с пестиком, шпатели) и мерная (бюретки, пипетки, мерные колбы, цилиндры, мензурки, стаканы) посуда; спиртовка, держатель для пробирок, асбестированная сетка, фарфоровый треугольник, тигельные щипцы, водяные бани, сушильный шкаф, муфельная печь, эксикатор, воронки для фильтрования (обычная и воронка Бюхнера), колба Бунзена, водоструйный вакуумный насос, лабораторный штатив с лапками и кольцами, технохимические и аналитические весы, бумажные фильтры, металлический цинк.
Техника безопасности при работе в лаборатории общей химии
1.1.1 Во время работы в лаборатории необходимо соблюдать порядок и чистоту, не шуметь, быть внимательным и аккуратным. 1.1.2 Лабораторные опыты выполняются в спецодежде. Желательно при себе иметь чистое полотенце. 1.1.3 Не начинать выполнение опыта, не ознакомившись с его содержанием и не убедившись в наличии необходимых приборов, посуды, реактивов. 1.1.4 При работе точно соблюдать порядок и последовательность операций, указанных в руководстве. 1.1.5 Без указания преподавателя не проводить никаких дополнительных опытов. 1.1.6 Все работы с сильно пахнущими и вредными веществами, щелочными металлами, концентрированными кислотами и щелочами проводить в вытяжном шкафу. Операция выпаривания также проводится под тягой, если при этом образуются вредные пары или газы. 1.1.7 Не выливать в раковину отработанные концентрированные растворы кислот и щелочей, огнеопасные и сильно пахнущие вещества, органические растворители. Для этого следует пользоваться специальными банками, установленными под тягой. 1.1.8 При приготовлении растворов серной кислоты кислоту приливают в воду при перемешивании, а не наоборот. 1.1.9 В лаборатории запрещается принимать пищу, пить воду из химической посуды, нельзя ничего пробовать на вкус. Нюхать вещества следует, не вдыхая пары или газы полной грудью, а направляя их к себе движением руки. 1.1.10 Запрещается выполнение опытов в грязной посуде. 1.1.11 При сливании реактивов не наклоняться над сосудом. Брызги могут попасть на лицо и одежду. 1.1.12 Не наклоняться над сосудом с кипящей жидкостью. Для равномерного кипения можно использовать кипелки – кусочки фарфора, керамики или другого пористого материала. 1.1.13 Пробирку с нагреваемой жидкостью следует держать отверстием от себя и от людей, находящихся рядом. 1.1.14 Нельзя ставить влажную снаружи стеклянную посуду на горячую электроплитку или посуду с кипящей жидкостью на холодную и влажную поверхность. 1.1.15 Запрещается проводить какие-либо работы с легковоспламеняющимися веществами вблизи от огня. 1.1.16 Не выбрасывать в раковину и мусорную корзину остатки щелочных металлов, их собирают в склянку с обезвоженным керосином. 1.1.17 Необходимо помнить, что концентрированная азотная кислота при попадании на некоторые органические вещества (промасленная бумага, ветошь, деревянная стружка) вызывает их воспламенение. 1.1.18 Перед включением в сеть электроприборов необходимо проверить заземление их корпуса. 1.1.19 Нельзя затягивать в пипетки ртом вредные жидкости, для этого используют резиновые груши. 1.1.20 После окончания работы необходимо вымыть посуду и привести в порядок рабочее место.
1.2 Помощь при несчастных случаях
1.2.1 При попадании на кожу концентрированных кислот обожженное место следует промыть большим количеством воды, а затем 2 – 3% - ным раствором соды, после чего – снова водой. 1.2.2 При ожогах концентрированными щелочами промыть обожженное место большим количеством воды и нейтрализовать 2% - ным раствором уксусной, борной или лимонной кислоты, после чего – снова промыть водой. 1.2.3 При попадании кислоты или щелочи на слизистую глаз нужно немедленно промыть глаза большим количеством воды и закапать их касторовым маслом. 1.2.4 При термических ожогах смочить поврежденное место 2% - ным раствором перманганата калия и наложить стерильную повязку. 1.2.5 В случае пореза стеклом нужно убедиться, что в ранке нет осколков, продезинфицировать ее раствором перманганата калия или спиртом, смазать вокруг раны йодом и перевязать бинтом. 1.2.6 При отравлениях газами пострадавшего необходимо вывести на свежий воздух, а в более тяжелых случаях немедленно вызвать врача. 1.2.7 В целях противопожарной безопасности химическая лаборатория снабжена огнетушителями, ящиком с песком и противопожарным одеялом для тушения небольших очагов пламени или горящей на человеке одежды. 1.2.8 В случае возникновения очага возгорания нужно выключить электронагревательные приборы и вентиляцию, убрать подальше все горючие вещества и тушить огонь. Горящие жидкости нужно накрыть войлоком или засыпать песком, но не заливать водой. В случае воспламенения щелочных металлов пламя гасят только сухим песком, но не водой. В случае более обширной площади возгорания следует воспользоваться огнетушителем. 1.2.9 Если с пожаром самостоятельно справиться не удается следует немедленно эвакуировать людей и вызвать пожарную команду.
1.3 Правила обращения с реактивами
1.3.1 Если в методике нет указаний о дозировке реактивов, то брать их надо в минимальных количествах: сыпучие вещества должны едва прикрывать дно пробирки, а растворы занимать 1/6 объема пробирки. 1.3.2 Если на склянке с реактивом нет этикетки, пользоваться им без согласования с преподавателем нельзя. 1.3.3 Излишек реактива не высыпать и не выливать обратно в сосуд, из которого он был взят, использовать для этого специальные емкости, указанные преподавателем. 1.3.4 Сухие реактивы берутся шпателями, которые должны быть сухими и чистыми. 1.3.5 Если жидкий реактив отбирается пипеткой, то нельзя той же пипеткой, не вымыв ее, брать реактив из склянки с другим веществом. 1.3.6 После употребления реактива банку или склянку тот час же закрыть пробкой и поставить на место.
1.4 Химическая посуда и оборудование
Чаще всего в лаборатории общей химии используется стеклянная посуда. Она устойчива к действию большинства химических реагентов, легко моется, прозрачна. Однако ею нельзя пользоваться при работе с плавиковой кислотой (водный раствор HF), с расплавленной щелочью, в ней нельзя нагревать концентрированные растворы щелочей. Наиболее часто используемая стеклянная химическая посуда представлена на рисунке 1.1. Пробирки различной величины и диаметра могут быть обычными, для проведения опытов с веществами и растворами, и коническими. Конические пробирки удобны для проведения качественных реакций и центрифугирования. Стаканы служат для вспомогательных операций чаще всего с водными растворами веществ. Эту посуду изготавливают из обычного химически стойкого стекла или из тугоплавко стекла (термоустойчивые стаканы). Вместимость может быть от 50 миллилитров до 2 литров.
а б в г д е
ж з и Рисунок 1.1 – Стеклянная химическая посуда: а – плоскодонные колбы;
Плоскодонные и конические колбы используют как емкости для жидкостей, для приготовления растворов и кристаллизации, в качестве приемников при перегонке жидкостей. Их нельзя применять в процессах, проводимых под вакуумом. Круглодонные колбы могут служить химическими реакторами, применяться для перегонки жидкостей, в том числе и под вакуумом. Толстостенная колба Бунзена с фарфоровой воронкой Бюхнера используется для фильтрования при пониженном давлении. При обычном фильтровании необходима стеклянная воронка с бумажным фильтром. Кристаллизаторы – это неглубокие сосуды с широким дном, предназначенные для охлаждения веществ при их получении или кристаллизации. Для хранения гигроскопичных веществ используют бюксы – стеклянные сосуды с притертыми крышками. Широко используемая в химическом практикуме фарфоровая посуда изображена на рисунке 1.2. Ступка с пестиком служит для растирания веществ. Фарфоровые чашки применяются для выпаривания жидкостей и проведения некоторых опытов при нагревании. Фарфоровые тигли используют для прокаливания и сплавления веществ. Они выдерживают прямой нагрев на открытом пламени или в муфельной печи. Фарфоровые шпатели и ложечки, наряду со стеклянными и металлическими, служат для забора сухих веществ. Для закрепления лабораторной посуды и сборки оборудования и приборов используют металлические штативы с лапками и кольцами. При нагревании пробирки закрепляют в держателе, горячие тигли и чашки переносят при помощи тигельных щипцов. Мерной (измерительной) называется посуда, которую применяют в лабораториях для измерения объемов жидкостей или газов. Она представлена на рисунке 1.3.
а б в г д е
ж з
Рисунок 1.2 – Фарфоровая посуда и металлические приспособления: а – воронка Бюхнера; б – тигель; в – фарфоровая чашка; г – ступка с пестиком; д – шпатели; е – металлический штатив с лапками и кольцами; ж – держатель для пробирок; з – тигельные щипцы
Мерные цилиндры и мензурки позволяют относительно грубо измерить объем жидкости. Бюретки представляют собой стеклянные трубки с градуировкой. С их помощью можно точно измерять объемы вытекающей жидкости или выделяющегося газа. На носике бюретки находится стеклянный кран, либо резиновая трубка с зажимом или стеклянным шариком. Жидкость должна вытекать со скоростью 25 – 30 мл/мин. Емкость бюреток от 2 до 100 мл. Точность измерения 0,1%. Отсчет показаний ведется по нижнему краю вогнутого мениска[*], находящегося на уровне глаз наблюдателя, либо по верхнему краю выпуклого мениска или мениска непрозрачной жидкости. Мерные пипетки предназначены для взятия точного объема жидкости. Используются как градуированные пипетки, так и простые. Градуированные пипетки можно использовать для отмеривания либо всего объема емкости пипетки, либо части его. Простые пипетки имеют утолщение в средней части и применяются только для измерения объема, указанного на поверхности пипетки и отмеченного кольцевой меткой на трубочке.
а б
в г д
Рисунок 1.3 – Мерная посуда: а – цилиндры; б – мензурки; в – мерные колбы; г – бюретки; д – пипетки
Засасывание жидкости производят с помощью резиновой груши, надетой на верхний конец пипетки (в случае разбавленных безвредных растворов можно применять всасывание ртом). Необходимо следить, чтобы нижний конец пипетки всегда был в жидкости. Набрав жидкость несколько выше метки, снимают грушу и закрывают отверстие указательным пальцем, удерживая пипетку большим и средним пальцами. Ослабляя нажим указательного пальца, сливают лишнюю жидкость до тех пор, пока нижний край мениска не коснется метки. При выливании жидкости пипетку держат вертикально, прислонив кончик к стенке сосуда. В носике пипетки всегда остается небольшое количество жидкости. Этот остаток всегда одинаков и учтен при калибровке, поэтому не следует стараться его вытеснить. Точность измерения объема пипеткой достигает 0,2%. Мерные колбы используют для приготовления растворов определенной концентрации, либо для разбавления раствора в заданное число раз. Объем колбы до круговой метки на горлышке и температура, при которой проводилась градуировка, обозначены на стекле. Точность измерения объема 0,12%. Для приготовления раствора в мерную колбу с помощью воронки помещают навеску или точный объем вещества. Обмывают воронку дистиллированной водой и наливают воду на треть объема колбы. Растворяют вещество, тщательно перемешивая содержимое колбы. Затем доливают воду до метки, закрывают колбу пробкой и переворачивают колбу 10 – 12 раз.
1.5 Техника нагревания и охлаждения
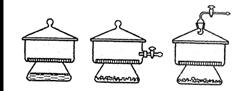
Для нагревания и прокаливания в химической лаборатории используют спиртовки, газовые горелки, электроплитки, электрические сушильные шкафы и печи. Выбор нагревательного прибора зависит от температуры и длительности нагрева. Если нужно нагреть содержимое пробирки, пользуются спиртовкой или газовой горелкой. Нужно помнить, что наиболее высокая температура соответствует верхней наружной части пламени. Пробирку закрепляют в держателе или лапке штатива, при этом отверстие пробирки должно быть повернуто в сторону от работающих людей. Сначала пробирку равномерно прогревают по всей длине, затем осторожно нагревают содержимое пробирки от верхней границы жидкости ко дну, периодически встряхивая пробирку. Для предотвращения вскипания и выплескивания реакционной смеси пробирку нагревают в верхней части пламени до появления первых признаков закипания, затем ее следует убрать из пламени, продолжая нагревать горячим воздухом, при необходимости внося на короткое время в область пламени. Растворы в термоустойчивых колбах и химических стаканах, фарфоровых чашках, фарфоровых тиглях нагревают на газовых горелках или электрических плитках. Если нагревание ведут на электрических плитках с закрытой спиралью, то под посуду подкладывают асбестированную металлическую сетку. Над открытым пламенем горелки можно нагревать только фарфоровые тигли, закрепленные в фарфоровых треугольниках, или круглодонные термостойкие колбы, установленные в металлические кольца штативов. Для высушивания твердых веществ (доведение до постоянной массы, высушивание после фильтрования) используют сушильные шкафы, помещая вещества в фарфоровые чашки, чашки Петри или фарфоровые тигли. Максимальная температура нагрева составляет 2000С. Для длительного нагревания растворов, например, при выпаривании, или для нагревания реакционных смесей применяют бани для нагрева. Они обеспечивают равномерное и безопасное нагревание, препятствуют возникновению пожаров. Бани бывают водяные, масляные, воздушные, песчаные. Выбор теплопроводящей среды определяется свойствами нагреваемого вещества и необходимой температурой нагрева. Водяные бани применяют при нагревании до 1000С, масляные – до 1500С, воздушные – до 2500С, песчаные – до 4000С. Если требуется прокаливание твердых веществ или их сплавление при температурах выше 2000С используют электрические печи – муфельные, тигельные, трубчатые. Вещества помещают в фарфоровые тигли или лодочки. Для охлаждения прокаленных или сплавленных веществ в атмосфере сухого воздуха (если вещества гигроскопичны) используют эксикаторы. Они изображены на рисунке 1.4. Это сосуды из толстостенного стекла с притертой крышкой. Для более плотного прилегания края крышки смазывают вазелином или вакуумной смазкой. Внутри эксикатора имеется фарфоровая перегородка с крупными отверстиями. Под перегородку помещают осушитель – вещество, хорошо поглощающее влагу (прокаленный хлорид кальция, оксид фосфора(V), концентрированная серная кислота и другие). На перегородку ставят охлаждаемое вещество в фарфоровых чашках или тиглях. Чтобы поместить вещество в эксикатор, сдвигают крышку скользящим движением и опускают тигель или чашку с веществом, прихватив их щипцами. Эксикатор быстро закрывают, надвигая чашку скользящим движением. После этого в течение нескольких секунд надо придерживать крышку, чтобы она не приподнялась под давлением расширяющегося воздуха. Эксикаторы можно также использовать для медленного высушивания или хранения гигроскопических веществ. В последнем случае вещества помещают в закрытые бюксы.
Рисунок 1.4 – Эксикаторы
Для измерения температуры можно использовать термопары или термометры (гораздо чаще). Термометры могут быть жидкостные или ртутные. Ртутные термометры требуют повышенной осторожности в обращении. Нужно предусмотреть меры по механическому сбору и химическому обезвреживанию разлившейся ртути (20%-ный раствор FeCl3, подкисленный раствор KMnO4
1.6 Техника фильтрования
Отделение осадка от раствора можно проводить фильтрованием. Для выяснения особенностей этого процесса можно обратиться к рисунку 1.5. При обычном фильтровании используют стеклянную воронку и бумажный фильтр, края которого должны находиться на 5 мм ниже краев воронки. Фильтр смачивают дистиллированной водой для плотного прилегания к стеклу. Фильтруемый раствор небольшими порциями по стеклянной палочке сливают в воронку. Уровень жидкости в воронке должен быть ниже краев фильтра. Ускоренное фильтрование можно проводить при пониженном давлении. Для этого собирают установку, состоящую из колбы Бунзена (1), воронки Бюхнера (2) и водоструйного насоса (3), соединенного с водопроводным краном и колбой Бунзена (желательно через предохранительную склянку). На дно воронки кладут круглый бумажный фильтр, совпадающий по диаметру с дном воронки. Фильтр смачивают водой или растворителем для более плотного прилегания. Открывают водопроводный кран, при этом из колбы откачивается воздух (разряжение может достигать 8 – 15 мм рт.ст.). Затем по стеклянной палочке в воронку сливают разделяемую смесь. После окончания фильтрования осадок промывают водой или растворителем и отжимают на фильтре плоской стеклянной пробкой. Затем отсоединяют резиновый шланг от колбы и только потом выключают водоструйный насос. Если порядок отключения будет нарушен, воду из водоструйного насоса может перебросить в колбу.
а б Рисунок 1.5 – Фильтрование: а – при пониженном давлении; б – обычное с бумажным фильтром
При фильтровании в присутствии веществ, разрушающих бумагу (кислоты, щелочи, окислители), применяют пористые стеклянные фильтры с различным диаметром пор.
1.7 Весы и взвешивание
Взвешивание – это определение массы тела при помощи весов. Массу тела находят преимущественно уравновешиванием его веса известной противодействующей или уравновешивающей силой. Чаще всего уравновешивающей силой является вес гирь или разновесок – тел с точно установленной массой. Взвешивание основано на том, что для двух тел, находящихся в одной и той же точке земли, в одних и тех же условиях, отношение весов равно отношению масс:
где Р и РЭ – вес взвешиваемого и эталонного тела соответственно; m и mЭ – масса взвешиваемого и эталонного тела соответственно. Поэтому при равновесии весов, когда вес тела Р равен весу эталонного тела РЭ (весу гирь), масса взвешиваемого тела m, будет равна массе гирь mЭ. В быту приходится встречаться с различными типами весов. Обычно это весы для грубого взвешивания, их точность не выше 1 – 2 граммов. В химической лаборатории используют более точные весы, которые можно разделить на три группы: общелабораторные или технохимические, аналитические, специальные весы. Общелабораторные или технохимические весы используют для технических анализов, взвешивания химических реактивов и других целей. Точность весов этого вида может лежать в диапазоне от 1г до 0,001г, однако чаще всего пользуются весами с точностью 0,01г. Аналитические весы применяют для точных анализов. Точность этих весов 10-4 – 10-5г. Кроме того, существуют еще более точные весы: полумикро-, микро- и ультрамикроаналитические. Точность последних может достигать 10-9г. Специальные весы служат для определения массы в особых условиях, например, при высоком давлении, высоких или низких температурах.
1.7.1 Устройство технохимических весов и правила обращения с ними
Технохимические весы изображены на рисунке 1.6. Технохимические весы имеют коромысло (2), на котором укреплены три призмы: две на концах коромысла (обращены ребром вверх) и одна посередине (обращена ребром вниз). Своей средней призмой коромысло опирается на площадку, укрепленную на центральной колонке весов. Чашки весов (4) посредством серег подвешены на концевые призмы. Для определения состояния равновесия служат стрелка (8) и шкала с делениями (6). Весы имеют арретир (7). Арретир приподнимает коромысло с чашками весов, освобождая призмы от контакта с площадками. Это предохраняет призмы от преждевременного изнашивания и прекращает качания коромысла. Неработающие весы всегда должны быть арретированы. Весы смонтированы на площадке, снабженной установочными винтами (5), которые служат для настройки весов по отвесу (3). Если площадка весов установлена горизонтально, острие отвеса совпадает с острием неподвижного конуса на площадке. На концах коромысла имеются две балансировочные гайки (1), вращением которых весы корректируются до начала взвешивания, так чтобы при качании коромысла стрелка отклонялась влево и вправо на одинаковое число делений шкалы (6).
Рисунок 1.6 – Технохимические весы
В рабочее положение весы приводят плавным поворотом по часовой стрелке арретирующего устройства. На чашки весов запрещается ставить горячие или грязные предметы, брать разновески (гирьки) без пинцета. Класть на весы предметы и разновески можно только при арретированных весах. Взвешиваемые предметы кладут на левую чашку весов обязательно на листочке бумаги или в химической посуде, массу которых определяют заранее. Разновески кладут на правую чашку весов до тех пор, пока весы не уравновесятся. Суммарная масса разновесок равна массе взвешиваемого предмета. После взвешивания разновески должны быть возвращены на место, а весы арретированы. При выполнении одной работы взвешивать нужно на одних и тех же весах с одним и тем же разновесом.
1.7.2 Устройство аналитических весов и правила обращения с ними
Познакомимся с равноплечими аналитическими демпферными весами и техникой взвешивания на них. Основные части этих весов показаны на рисунке 1.7. Весы заключены в витрину с боковыми дверцами. Витрина закреплена на основании, на котором также крепится колонка (1). При помощи регулируемых ножек основание весов устанавливается строго горизонтально по уровню. На колонке крепятся два кронштейна с воздушными успокоителями колебаний – демпферами (2). На вершине колонки помещена опорная площадка, на которую опирается средняя призма коромысла (3). На концах коромысла имеются грузоприемные призмы, на них подвешиваются серьги с грузоприемными площадками. На верхние крючки серег подвешиваются чашки весов (4), на нижние – стаканы демпферов. Весы снабжены встроенными разновесками, которые навешиваются на планку, скрепленную с правой серьгой. Управление разновесками происходит при помощи вращающихся лимбов (5) через рычаги. На конце стрелки весов (7) имеется микрошкала (6.), которая при помощи оптического устройства проецируется на освещаемый экран. Чувствительность весов в значительной мере зависит от того, насколько остро отточены острия призм, и как хорошо отполированы площадки, на которые эти призмы опираются. Чтобы призмы не истирались, весы снабжены арретиром (8). Когда весы арретированы, призмы не касаются опорных площадок. В таком состоянии они должны находиться, когда весами не пользуются, накладывают разновески или взвешиваемые предметы.
Рисунок 1.7 – Аналитические весы
Проводя взвешивание на аналитических весах, необходимо соблюдать ряд правил. Нельзя нагружать аналитические весы сверх установленной нормы. Если масса предмета вызывает сомнение, его предварительно следует взвесить на технохимических весах. Разновески следует брать только пинцетом. Ставить предметы и разновески на чашки весов или снимать их с чашек разрешается только после арретирования весов. Поворачивать рукоятку арретира следует плавно и осторожно. Вещества взвешиваются только в специальной посуде (тигли, бюксы, часовые стекла), а если нет опасности потери вещества, то на кусочках бумаги. Нельзя ставить на чашки весов горячие, влажные или грязные предметы. Нельзя сдвигать весы, просыпать и проливать реактивы внутри витрины весов. Вещества, выделяющие пары или газы, следует взвешивать только в герметично закрытой посуде. Для уменьшения влияния погрешностей на результаты опыта все взвешивания проводятся на одних и тех же весах, с использованием одного и того же разновеса. По окончании работы весы должны быть арретированы, взвешиваемый предмет и разновески убраны с чашек весов, дверцы закрыты, малый и большой лимбы поставлены в нулевое положение, штепсельная вилка вынута из розетки. 1.8 Методика проведения опыта
1.8.1 Взвешивание цинка на аналитических весах
Включить осветитель весов при помощи штепсельной вилки. Привести весы в рабочее состояние, повернув рукоятку арретира, при этом автоматически включается лампочка осветителя. На экране вейтографа появляется движущееся изображение шкалы. Установить нулевую точку весов, совместив неподвижную вертикальную линию на экране (риску) с нулевым делением шкалы. Этого можно добиться вращением регулировочного винта экрана. Арретировать весы. Открыв боковую дверцу, на левую чашку весов поместить кусочек цинка на предварительно взвешенной бумажке массой m1. Для взвешивания с точностью до 1г на правую чашку весов помешают гирьки. Так как в данной работе предстоит взвесить с точностью до 0,0002г навеску цинка массой около 0,02 – 0,03г, а масса кусочка бумаги также меньше 1г, то на правую чашку весов гирьки ставить не требуется. Закрыв дверцу, приступить к взвешиванию. Поворачивая большой лимб, производят взвешивание с точностью до десятых долей грамма так, чтобы был недовес (риска находится в положительной части шкалы). Поворачивая малый лимб, производят взвешивание с точностью до сотых долей грамма. Взвешивание считается законченным, когда риска находится в пределах положительных значений шкалы от 0 до 10. Тысячные и десятитысячные доли грамма узнают по шкале после того, как колебания прекратятся. Определить массу цинка с бумажкой m2, суммируя показания по большому, малому лимбу и шкале весов. Масса цинка определяется по разности m2 – m1. Взвешенный кусочек цинка завернуть в бумагу, на которой написать его массу, и сохранить до следующей лабораторной работы.
1.9 Требования к уровню подготовки студентов
˗ Знать общие правила и технику безопасности при работе в химической лаборатории. ˗ Уметь оказать первую помощь при несчастных случаях. ˗ Знать назначение наиболее часто используемой химической посуды и лабораторного оборудования, правила пользования ими. ˗ Уметь выполнять операции нагревания и охлаждения, фильтрования, взвешивания, измерения температуры. ˗ Знать принципиальную схему устройства технохимических и равноплечих демпферных аналитических весов.
1.10 Задания для самоконтроля
1.10.1 Почему нельзя выливать в раковину концентрированные растворы кислот и щелочей, органические растворители, выбрасывать остатки щелочных металлов? 1.10.2 Какую последовательность следует соблюдать при приготовлении разбавленного раствора из концентрированной серной кислоты? 1.10.3 Почему запрещается проводить опыты в грязной посуде? 1.10.4 Что нужно предпринять при попадании капель концентрированной кислоты или щелочи на кожу? 1.10.5 Нарисуйте схему частей пламени спиртовки или горелки. В какой части пламени температура максимальна? 1.10.6 Какие правила необходимо соблюдать при нагревании жидкости в пробирке на пламени спиртовки и в стакане на электроплитке? 1.10.7 Какую посуду называют мерной, для чего она используется? 1.10.8 Какая фарфоровая посуда используется в лаборатории, и для каких целей? 1.10.9 Какие способы проведения фильтрования вы знаете? 1.10.10Что такое арретир, для чего он нужен в весах? 1.10.11На правой чашке уравновешенных технохимических весов находятся разновески достоинством 10г, 2г, 50 мг. Какова масса взвешиваемого предмета? 1.10.12Масса навески вещества составляет 5,2387г. На какое деление подвижной шкалы аналитических весов указывает риска на экране вейтографа?
1.11 Список рекомендуемой литературы
1.11.1 Коровин Н.В. Лабораторные работы по химии: Учеб. пособие для техн. направлений и спец. вузов/ Н.В.Коровин, Э.И. Мингулина, Н.Г.Рыжова. Под ред. Н.В.Коровина. – М.: Высш. шк., 2007. – 256 с. 1.11.2 Практикум по общей и неорганической химии: Учеб. пособие/ Л.С.Гузей, В.Н.Кузнецов, Г.П.Жмурко и др. – М.: Изд-во МГУ, 2000. – 88 с. 2 Лабораторная работа №2 Определение молярной массы химического эквивалента металла Цель работы: познакомиться с понятием химического эквивалента, определить молярную массу химического эквивалента цинка методом вытеснения водорода.
Оборудование и реактивы: прибор для определения молярной массы эквивалента металла, термометр, барометр, 25%-ный раствор соляной кислоты, металлический цинк.
2.1 Теоретические пояснения
Химическим эквивалентом называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна (равноценна) одному иону водорода в кислотно-основных и ионообменных реакциях, либо одному электрону в окислительно-восстановительных реакциях. Реальные частицы – это атомы, ионы, молекулы и другие частицы. Условные частицы в действительности не существуют, но используются при расчетах. Это, например, 1/2 Н2SO4, 1/4 C, 1/3 Fe3+. В общем случае эквивалент любого вещества X может быть записан в виде 1/z(X), где z – число эквивалентности, или эквивалентное число, которое всегда больше или равно единице. Оно показывает, сколько эквивалентов содержится в одной формульной единице вещества. Дробное число 1/z называется фактором эквивалентности. Для данного вещества z находится по конкретной реакции. В окислительно-восстановительных процессах z определяется числом электронов, принятых или отданных одной формульной единицей вещества. Рассмотрим окислительно-восстановительную реакцию S + O2 = SO2 S0 - 4e- = S+4 O2 + 4e- = 2O -2. Формульная единица серы отдает 4 электрона, а одна формульная единица молекулярного кислорода принимает 4 электрона. Следовательно, эквивалентное число z для серы и для кислорода равно четырем. Поэтому эквивалент серы в приведенной реакции – это условная частица ¼ S, а эквивалент кислорода – условная частица ¼ О2. В кислотно-основных и ионообменных процессах эквивалентное число определяется стехиометрией реакции, причем для одного и того же вещества, в зависимости от реакции, эквивалентное число может иметь различные значения. В качестве примера рассмотрим две реакции: 1) H2SO4 + NaOH = NaHSO4 + H2O; 2) H2SO4 + 2NaOH = Na2SO4 + 2H2O. Определим эквивалент серной кислоты в этих реакциях. Для этого нужно знать эквивалент какого-либо другого компонента реакции, например гидроксида натрия. На основании определения эквивалента, для гидроксида натрия эквивалентом является реальная частица NaOH, для нее z = 1. В дальнейших рассуждениях нужно опираться на стехиометрию реакции. В соответствии с уравнением первой реакции, один эквивалент NaOH взаимодействует с одной частицей H2SO4. Поэтому число эквивалентности для серной кислоты в этой реакции равно 1, а эквивалентом будет являться реальная частица H2SO4. По второй реакции два эквивалента гидроксида натрия реагируют с одной частицей серной кислоты, тогда один эквивалент NaOH взаимодействует с условной частицей 1/2H2SO4, которая и будет являться эквивалентом серной кислоты во второй реакции. Таких частиц в формульной единице H2SO4 две, поэтому для серной кислоты в данной реакции z = 2. Когда речь не идет о конкретной реакции, при определении z для сложных веществ можно воспользоваться следующими правилами: ˗ для оксидов z равно числу атомов элемента, умноженному на степень окисления элемента; ˗ для кислот z равно основности кислоты; ˗ для оснований z равно кислотности основания; ˗ для солей z равно числу катионов металла, умноженному на заряд катиона. Количество вещества эквивалента обозначается n(1/z(X)). Единица измерения – моль. Один моль эквивалента вещества содержит 6,022×1023 эквивалентов. Молярная масса эквивалента М(1/z(X)) – это масса 1 моль эквивалентавещества 1/z(X), измеряется в г/моль. Связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества выражается соотношениями:
Экспериментальное определение молярной массы химического эквивалента цинка в данной работе основано на законе эквивалентов: эквивалентные количества всех веществ, участвующих в реакции, одинаковы. Таким образом, для любой пары компонентов реакции справедливо равенство (2.2). n(1/z1(X1)) = n(1/z2(X2)) (2.2) Учитывая соотношение (2.1), данное равенство можно преобразовать к виду Итак, массы реагирующих друг с другом веществ, а также массы продуктов реакции относятся друг к другу как молярные массы их эквивалентов. Если один из компонентов реакции, допустим Х1, находится в газообразном состоянии, то для него справедливы соотношения (2.4) и (2.5).
где V(X1) – объем газообразного вещества X1 в данных условиях; VM(1/z(X1)) – объем, занимаемый одним моль эквивалента вещества Х1 в тех же условиях; VM(X1) – молярный объем вещества Х1. С учетом формулы (2.4) для газообразного компонента реакции, можно получить еще одно следствие из закона эквивалентов:
2.2 Методика проведения опыта
Устройство прибора для определения молярной массы эквивалента металла представлено на рисунке 2.1. Бюретка (1) емкостью 50 мл соединена резиновыми трубками с воронкой (2) и пробиркой (3). В бюретку наливают воду, которая должна также заполнять часть воронки.
Рисунок 2.1 – Прибор для определения молярной массы эквивалента металла
2.2.1 Перед началом опыта необходимо убедиться в герметичности прибора. Для этого пустую пробирку соединяют с бюреткой, и поднимают воронку так, чтобы уровень воды в ней был выше, чем в бюретке. При этом в приборе создается давление, превышающее атмосферное. Если уровень воды в бюретке не изменяется после незначительного первоначального повышения, то прибор герметичен и готов к работе. В противном случае следует исправить дефекты, допущенные при сборке прибора. 2.2.2 Влить в пробирку на 1/5 ее объема через воронку соляную кислоту. Стенки пробирки при этом должны остаться сухими. 2.2.3 Держа пробирку в наклонном положении, положить на ее стенку кусочек цинка, взвешенный в лабораторной работе №1 так, чтобы он не соприкасался с кислотой. 2.2.4 Присоединить пробирку к прибору, плотно закрыв ее пробкой. Убедиться, что герметичность прибора не нарушена. 2.2.5 Передвижением воронки привести воду в ней и бюретке к одному уровню. Отметить и записать уровень воды в бюретке V1, произведя отсчет по нижнему краю мениска (утолщенная поверхностная пленка воды в бюретке). Мениск должен находиться на уровне глаз. 2.2.6 Стряхнуть цинк в кислоту. По окончании реакции дать пробирке остыть до комнатной температуры, после чего снова привести воду в бюретке и воронке к одному уровню. Отметить и записать уровень воды в бюретке V2. Разность V2 – V1 равна объему выделившегося водорода в реакции Zn + 2 HCl = ZnCl2 + H2 2.2.7 Отметить показания термометра и барометра. 2.2.8 Результаты опыта занести в таблицу 2.1.
Таблица 2.1 – Результаты опыта
2.3 Обработка результатов опыта
2.3.1 По разности уровней воды в бюретке до и после протекания реакции вычислить объем выделившегося водорода при температуре и давлении опыта. 2.3.2 Так как водород собирается над водой, то он насыщен водяным паром. Общее давление в приборе равно атмосферному и складывается из парциальных давлений водяного пара и водорода. Чтобы вычислить парциальное давление водорода, нужно из атмосферного давления Р вычесть величину давления h насыщенного при температуре опыта водяного пара. P(H2)=P-h (2.7) Для нахождения h следует воспользоваться данными таблицы 2.2. Таблица 2.2 – Давление насыщенного водяного пара при различных температурах
2.3.3 Привести объем выделившегося водорода к нормальным условиям
2.3.4 Рассчитать экспериментальное значение молярной массы эквивалента цинка в г/моль по закону эквивалентов в соответствии с формулой (2.6):
где VM(1/2 H2) – объем, занимаемый одним моль эквивалента газообразного водорода, равный половине молярного объема водорода, т.е. 11,2 л/моль. 2.3.5 Рассчитать теоретическое значение молярной массы эквивалента цинка, зная молярную массу цинка и эквивалентное число z, численно равное числу электронов, отданных цинком в ходе окислительно-восстановительной реакции с соляной кислотой. MТЕОР.(1/2 Zn) = M(Zn):2 (2.11) 2.3.6 Вычислить относительную ошибку опыта по формуле
2.4 Примеры решения задач
Пример 1 Определить молярную массу эквивалента Fe2(SO4)3 в реакции Fe2(SO4)3 + 6 NaOH = 2 Fe(OH)3 + 3 Na2SO4. Решение Одна формульная единица гидроксида натрия взаимодействует с одним ионом водорода, поэтому эквивалент щелочи есть реальная частица NaOH. По стехиометрии реакции на одну частицу NaOH (эквивалент) приходится 1/6частицы Fe2(SO4)3, поэтому эквивалентом сульфата железа (III) в данной реакции будет условная частица 1/6 Fe2(SO4)3. Молярная масса эквивалента сульфата железа (III) в данной реакции может быть вычислена по формуле M(1/6 Fe2(SO4)3) = M(Fe2(SO4)3) / 6 = 400 / 6 = 66,7 (г/моль). Пример 2 Хлорид никеля массой 2,918 г взаимодействует с 1,8 г гидроксида натрия, молярная масса эквивалента которого равна 40 г/моль. Вычислить молярную массу эквивалента хлорида никеля.
Решение В соответствии с законом эквивалентов m(хлорида) / m(NaOH) = M(1/z хлорида) / M(1/1 NaOH). Отсюда M(1/z хлорида) = 2,918 × 40 : 1,8 = 64,8 (г/моль) Пример 3 При сжигании 2,96 г металла было получено 4,91 г его оксида. Определить молярную массу эквивалента металла.
Решение Найдем массу кислорода, израсходованного при горении металла. В соответствии с законом сохранения массы веществ m(O2) = m(оксида) – m(металла) = 4,91 – 2,96 = 1,95 (г). При окислении металлов до оксидов газообразным кислородом происходит процесс: О20+4е-=2О–2. Молекула кислорода принимает 4 электрона, следовательно, z = 4. На один электрон приходится 1/4 О2, поэтому эквивалент молекулярного кислорода – это 1/4 O2, а молярная масса эквивалента равна По закону эквивалентов m(O2) / m(Me) = M(1/4 O2) / M(1/z Me); Отсюда выразим M(1/z Me) и подставим численные значения величин: M(1/z Me) = 2,96 × 8 / 1,95 = 12,1 (г/моль). 2.5 Требования к уровню подготовки студентов
˗ Знать понятия: эквивалент, число эквивалентности, количество вещества эквивалента, молярная масса эквивалента. ˗ Уметь выражать связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества. ˗ Знать закон эквивалентов, уметь применять его для нахождения масс и молярных масс веществ, участвующих или образующихся в реакции. ˗ Уметь определять молярную массу эквивалента элемента, эквивалент и молярную массу эквивалента вещества в реакции.
2.6 Задания для самоконтроля
2.6.1 Определить молярную массу эквивалента SO2 в реакции SO2+2H2S=3S+2H2O 2.6.2 Для каких веществ максимальное значение эквивалентного числа в ионообменных реакциях одинаково: а) H3PO4; б) Na2CO3; в) Al(OH)3; г) HNO3? 2.6.3 Определить эквивалент оксида лития в реакции Li2O+H2O=2LiOH 2.6.4 Чему равна масса 2 моль эквивалентов Ca(OH)2? 2.6.5 Молярная масса эквивалента алюминия 8,99 г/моль. Сколько граммов этого металла потребуется для восстановления меди из 30,0 г оксида меди(II)? 2.6.6 Когда количество вещества эквивалента равно количеству вещества? 2.6.7 Определить молярную массу эквивалента Fe(OH)2Cl в реакциях: а) Fe(OH)2Cl + NaOH = Fe(OH)3 + NaCl; б) Fe(OH)2Cl + 2 HCl = FeCl3 + 2 H2O. 2.6.8 Почему молярная масса элемента постоянна, а молярная масса его эквивалента может изменяться? 2.6.9 Может ли молярная масса эквивалента элемента или вещества быть больше его молярной массы и почему? 2.6.10 Определить молярную массу эквивалента металла в соединениях: CuSO4 × 5 H2O; KCl; CaSO4; Fe2O3. 2.6.11 Найти массу алюминия, если при его полном растворении в кислоте выделяется такое же количество водорода, что и при растворении 1,752 г цинка. Молярная масса эквивалента цинка равна 32,69 г/моль, молярная масса эквивалента алюминия – 8,99 г/моль. 2.6.12 Для нейтрализации кислоты гидроксидом калия на ее 1,866 г потребовалось 15 г гидроксида калия, молярная масса эквивалента которого равна 56 г/моль. Вычислите молярную массу эквивалента кислоты.
2.7 Список рекомендуемой литературы
2.7.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с. 2.7.2 Романцева Л.М. Сборник задач и упражнений по общей
Лабораторная работа №3 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 355. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





















 , (1.1)
, (1.1)

 (2.1)
(2.1)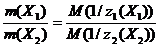 (2.3)
(2.3) (2.4)
(2.4) , (2.5)
, (2.5) (2.6)
(2.6)
 (2.8)
(2.8)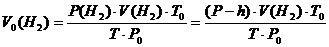 (2.9)
(2.9) , (2.10)
, (2.10) (2.12)
(2.12)