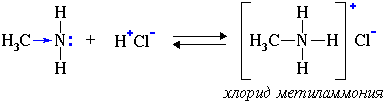Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Особенности строения и химические свойства.6.1. Свойства аминов как оснований (акцепторов протонов) Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота. 2. Взаимодействуя с кислотами, амины образуют соли:
Соли аминов – твердые вещества, хорошо растворимые в воде. При нагревании щелочи вытесняют из них амины:
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет. Таким образом, основные свойства (в газовой фазе) изменяются в ряду: C6H5NH2 < NH3 < RNH2 < R2NH < R3N 6.2. Взаимодействие с азотистой кислотой.Азотистая кислота HNO2 – неустойчивое соединение. Поэтому она используется только в момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой: KNO2 + HCl → НNO2 + KCl или NO-2 + H+ → НNO2 Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов.  Первичные алифатические амины c HNO2 образуют спирты: R – NH2 + HNO2 → R – OH + N2 + H2O
Первичные ароматические амины при повышенной температуре реагируют аналогично, образуя фенолы. Вторичные амины (алифатические и ароматические) под действием HNO2 превращаются в нитрозосоединения (вещества с характерным запахом): R2NH + H – O – N =O → R2N – N =O + H2O Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет практического значения. 6.3. Окисление аминов. Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени. 4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
6.4. Образование N-замещенных амидов кислот (ациламинов). Действием на первичные и вторичные амины галоидангидридов или ангидридов кислот можно заменить связанный с азотом атом водорода на кислотный радикал, причем получаются замещенные амиды органических кислот: CH3CO – Cl + H2N-R → CH3CO – NHR + HCl (CH3CO)2O + NH(CH3)2 → CH3CO – N(CH3)2 + CH3COOH
Третичные амины, не имеющие при атоме азота атом водорода, с галоидангидридами и ангидридами кислот не реагируют. 6.5. Действие галоидов. Действием хлора или брома в присутствии щелочи на первичные или вторичные амины можно заменить на галоид атомы водорода в аминогруппе и получить галоидамины: CH3NH2 + 2Br2 → CH3NBr2 + 2HBr (CH3)2NH + Br2 → (CH3)2NBr + HBr Бромамины – легко разлагающиеся вещества, с резким запахом. Взаимодействуют с водой с образованием аминов и бромноватистой кислоты. 6.6. Образование изонитрилов. Действием на первичные амины хлороформа в присутствии спиртовой щелочи получают изонитрилы: RNH2 + CHCl3 → R – N = C + 3HCl 6.7. Взаимодействие с галогенпроизводными. Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R, которая также эквивалентна уже имеющимся. 6.8. Конденсация с альдегидами и кетонами. Конденсация первичных аминов с альдегидами и кетонами приводит к образованию иминов или так называемых оснований Шиффа, соединений, содержащих фрагмент -N=C<: R – NH2 + O=CHR’ → R – N = CH – R’ + H2O R – NH2 + O=CR’R” → R – N = CR’R” + H2O
Реакция обратимая и экзотермическая, приводит к образованию иминов, или азометинов, или оснований Шиффа, в честь открывшего эти соединения. Имины широко используются в фармацевтической промышленности. Они служат исходным сырьем для производства ценных лекарственных препаратов: антибиотиков, противоаллергических, противовоспалительных и противоопухолевых средств. Их применяют также в качестве ингредиентов резиновых смесей и ингибиторов кислотной коррозии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ |
||
|
Последнее изменение этой страницы: 2018-05-27; просмотров: 195. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |