Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Физические свойства алкеновПри обычных условиях С2-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение алкенов Основные способы получения алкенов: 1. Дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей: CH3-CH2-CHBr-CH3 + KOH → CH3-CH = CH-CH3 + KBr + H2O 2. Дегалогенирование дигалогенпроизводных алканов под действием активных металлов CH3-CHCl-CHCl-CH3 + Zn → ZnCl2 + CH3-CH = CH-CH3 3. Дегидратация спиртов при нагревании с серной кислотой (t >1500C) или пропускании паров спирта над катализатором CH3-CH(OH)- CH3 → CH3-CH = CH2 + H2O 4. Дегидрирование алканов при нагревании (5000С) в присутствии катализатора (Ni, Pt, Pd) CH3-CH2 — CH3 → CH3-CH = CH2 + H2
Химические свойства алкенов Большинство химических реакций алкенов протекают по механизму электрофильного присоединения: 1. Гидрогалогенирование – взаимодействие алкенов с галогенводородами (HCl, HBr), протекающее по правилу В.В. Марковникова (при присое-динении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи) CH3-CH = CH2 + HCl → CH3-CHCl-CH3 2. Гидратация - взаимодействие алкенов с водой в присутствии мине-ральных кислот (серной, фосфорной) с образованием спиртов, протекающее по правилу В.В. Марковникова CH3-C(CH3) = CH2 + H2O → CH3-C(CH3)OH-CH3 3. Галогенирование — взаимодействие алкенов с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды CH2 = CH2 + Br2 → BrCH2-CH2Br При нагревании смеси алкена с галогеном до 5000С возможно замещение атома водорода алкена по радикальному механизму:  CH3-CH = CH2 + Cl2 → Cl-CH2-CH = CH2 + HCl 4. Гидрирования алкенов протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси: CH2 = CH2 + H2 → CH3-CH3 5. Окисление алкенов. Алкены способны окисляться с образованием различных продуктов, состав которых зависит от условий проведения реакции окисления. Так, при окислении в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомных спиртов: 3CH2 = CH2 + 2KMnO4 +4H2O → 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием кетоны, карбоновых кислот или углекислого газа:
Окисление этилена кислородом при 2000С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида: CH2 = CH2 +1/2O2 → CH3-CH = O 6. Полимеризация — процесс образования высокомолекулярного соединения – полимера путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов. Так, полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм): n CH2 = CH2 → -(-CH2-CH2-)n—
Ацетиленовые углеводороды, алкины Общие сведения, номенклатура ацетиленовых углеводородов Ацетиленовые углеводороды – это ненасыщенные углеводороды, имеющие в своем составе одну тройную связь. Тройная связь – это сочетание одной s- и двух p-связей. Общая формула алкинов -СnH2n-2 . По систематической номенклатуре ацетиленовые углеводороды называют, заменяя в названиях суффикс -ан в предельных углеводородах на суффикс -ин. Для алкинов характерна изомерия углеродного скелета, изомерия положения кратной связи. Пространственная изомерия не характерна. Таблица 6. Гомологический ряд ацетиленовых углеводородов
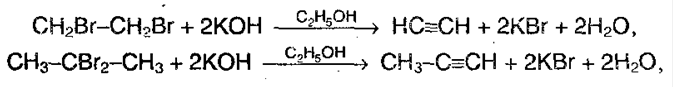
Физические свойства алкинов В нормальных условиях: С2-С4 – газы; С5 –С16 – жидкости; С17 и более – твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алканов. Растворимость в воде незначительна, немного выше, чем у алканов и алкенов, но все равно очень мала. Растворимость в неполярных органических растворителях высокая. На основе алкинов производят много различных соединений, имеющих широкое применение в промышленности. Например, получают изопрен – исходное соединения для производства изопренового каучука. Ацетилен используют для сварки металлов, т.к. процесс его горения весьма экзотермичный. Получение алкинов 1. Отщепление 2-х молекул галогенводорода от дигалогенааконов, которые находятся либо у соседних атомов углерода или у одного. Отщепление происходит под воздействием спиртового раствора щелочи:
2. Действие галогеналканов на соли ацетиленовых углевородородов:
3. Крекинг метана и его гомологов:
4. Реакции дегидрирования алканов и алкенов:
CH3-CH3 → СH≡CH + 2H2; CH2 = CH2 → СH≡CH + H2.
5. Ацетилен получают в лаборатории:
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-27; просмотров: 236. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |