
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Материальный баланс при массопередаче.
а) по всему веществу (2.1):
б) по распределяемому компоненту (2.2):
Если в нижней части аппарата провести произвольное сечение, то текущие концентрации в нем будут равны у и х, а материальный баланс по всему веществу и по распределяемому компоненту (2.3, 2.4):
Решая это уравнение относительно y, получим (2.5):
Уравнение прямой, выражающей связь между рабочими (текущими) концентрациями называется рабочей линией процесса.
Если рабочая линия расположена ниже линии равновесия, например, при ректификации, то для любой точки рабочей линии у<уР и х>хР. При этом распределяемый компонент будет переходить из фазы L в фазу G, стремясь к равновесным уР и хР.  Скорость массопередачи связана с механизмом переноса распределяемого вещества в фазах, между которыми происходит массообмен. Перенос вещества внутри фазы может происходить только путем молекулярной диффузии, либо путем конвекциии молекулярной диффузииодновременно. Молекулярная диффузия.В неподвижной среде распределяемое вещество переходит из внутренних слоев данной (первой) фазы к поверхности раздела фаз и, пройдя ее, распределяется по всему объему другой фазы, находящейся в контакте с первой. Такой переход массы вещества из одной фазы в другую называют молекулярной диффузией.Она является следствием теплового движения молекул (ионов, атомов), которому оказывают сопротивление силы внутреннего трения. Первый закон Фика – масса вещества dМ, продиффундировавшего за время dτ через элементарную поверхность dF (нормальную к направлению диффузии), пропорциональна градиенту концентрации
Знак минус в данном выражении указывает на то, что молекулярная диффузия протекает в направлении уменьшения концентрации распределяемого компонента. Коэффициент молекулярной диффузии Dпоказывает,какое количествовещества диффундирует в единицу времени через единицу поверхности при градиенте концентрации, равном единице (2.6):
Для неустановившегося процесса массообмена дифференциальное уравнение конвективного массообмена запишется в следующем виде (2.8):
где Второй закон Фика(дифференциальное уравнение молекулярной диффузии) - характеризует неустановившийся процесс массообмена в неподвижной среде (2.9):
Турбулентная диффузия–конвективный перенос вещества поддействием турбулентных пульсаций. Состояние равновесия-состояние,в которое с течением времениприходит физико-химическая система, находящаяся при неизменных внешних условиях, параметры системы в этом состоянии не меняются во времени. Фазовое равновесие–условие,при котором концентрации фаз неизменяются во времени. Константа фазового равновесия(коэффициент распределения) – соотношение между концентрациями фаз, устанавливаемое в состоянии равновесия, зависит от давления, температуры и концентрации распределяемого компонента (2.10):
Правило фазуказывает количество параметров,которыми можно влиятьна скорость протекания процесса (2.11):
где Ф – число фаз; С – число степеней свободы (число независимых переменных, которое можно изменить без нарушения состава фаз); К – число компонентов системы. Линия равновесия -графическое отображение зависимости междуконцентрациями распределяемого компонента в фазах при равновесии (2.12):
Закон Генри:парциальное давление компонента в газовой фазе надраствором Ра в условиях равновесия прямо пропорционально его мольной доли ха в жидкой фазе (2.13):
где ψ=f(t) – константа Генри, зависящая от температуры и определяемая для системы газ-жидкость экспериментально, Па. Закон Дальтона:общее давление в газовой смеси,состоящей из«n»компонентов, равно сумме их парциальных давлений (2.14):
где Р1, Р2 … Рn – парциальные давления компонентов. Закон Рауля:парциальное давление компонента в паровой фазе вусловиях равновесия равно произведению мольной доли компонента ха в жидкой фазе на давление его насыщенного пара РА (2.15):
Закон массоотдачи Щукарева:количество вещества М переносимого изядра потока к границе раздела фаз (или наоборот), прямо пропорционально движущей силе массоотдачи, поверхности контакта фаз F и времени процесса τ (2.16, 2.17): для фазы Фy для фазы Фx где Термодиффузия. Во многих процессах массообмена (сушка, варка, жарка и т.д.) возникает различие в направлениях распространения температуры и концентрации диффундируемого вещества. Температурный градиент направлен от периферии продукта к его центру, а градиент концентрации - от центра к периферии. В этом случае диффундируемое тяжелое вещество перемещается в направлении градиента температур, а легкое - в направлении градиента концентрации. Подобное явление получило название термодиффузии. При термодиффузии процесс массообмена может быть несколько затруднен, что объясняется противоположным направлением движения, например, влаги и паров при варке, жарке, сушке. Движение влаги в направлении градиента температур называется термовлагопроводностью. Перемещение влаги в направлении градиента концентрации является влагопроводностью, что по своему физическому смыслу равнозначно диффузии вещества. Поверхностная диффузия— это процесс, связанный (как и в случае объемной диффузии) с перемещением частиц (атомов, молекул или кластеров), происходящий на поверхности конденсированного тела в пределах первого поверхностного слоя атомов (молекул) или поверх этого слоя. Кнудсеновская диффузия— это перенос газов через сквозные поры в твердых телах при относительно малых давлениях газа или размерах пор. Коэффициент массоотдачипоказывает,какое количество веществапереносится из ядра потока к единице поверхности контакта фаз (или наоборот) в единицу времени при движущей силе массоотдачи, равной единице (2.18):
Уравнение массопередачиопределяет количество вещества М,переносимого из одной фазы в другую через границу раздела фаз F в единицу времени τ (2.19, 2.20):
где Массопередача, представляет собой сложный процесс, включающий в себя перенос массы (вещества) в пределах одной фазы, перенос через поверхность раздела и перенос в пределах другой фазы (2.21):
где М – общее количество вещества, перешедшего из одной фазы в другую за единицу времени; К – коэффициент массопередачи для всей поверхности Sконтакта фаз. Зависимость называется основным уравнением массопередачи. Согласно этому уравнению количество вещества М, перенесенное из одной фазы в другую за единицу времени пропорционально разности его текущей и равновесной концентраций ΔС и площади фазового контакта S. Коэффициент массопередачипоказывает,какое количество веществапереносится из одной фазы в другую фазу через единицу поверхности контакта фаз в единицу времени при движущей силе массопередачи, равной единице (2.22):
Если текущие концентрации изменяются при движении фаз вдоль поверхности раздела, то в качестве движущей силы выступает ее среднее значение, и уравнение массопередачи запишется в следующем виде (2.23, 2.24):
Уравнения аддитивности–уравнения связывающие коэффициентымассопередачи и массоотдачи между собой (2.25, 2.26):
где m – коэффициент распределения, определяется как тангенс угла наклона к линии равновесия; 1/Ку, 1/Кх – сопротивления массопередачи по фазе Фу и Фх соответственно; 1/βу, m/βх и 1/βх, 1/(mβу) – сопротивления массоотдачи по фазе Фу и Фх соответственно. Обобщенное критериальное уравнение массоотдачи(2.27):
Целью расчета массообменных аппаратовявляется определение егоосновных габаритов: диаметра Dап и высоты рабочей части H, где происходит изменение концентрации. Диаметр или сечение аппарата отражают его производительность, а высота — интенсивность протекающих в нем процессов. После завершения расчета размеров массообменных аппаратов возникает необходимость определения их гидравлического сопротивления. Диаметр аппаратаопределяется по уравнению расхода (2.28):
где Также диаметр или поперечное сечение S массообменного аппарата определяют по уравнению расхода (2.29):
где Q — объемный расход сплошной фазы, м3/с; w0 — приведенная (или фиктивная) скорость той же фазы, отнесенная к полному сечению аппарата, м/с. Высота рабочей части аппаратаопределяется в зависимости от способаконтакта фаз: 1) с непрерывным фазовым контактом в случае, если сопротивлением одной из фаз можно пренебречь 2) с непрерывным фазовым контактом, если необходимо учитывать сопротивление по обеим фазам 3) со ступенчатым фазовым контактом Теоретическая ступень (тарелка) -поверхность фазового контакта,накоторой успевает устанавливаться равновесие между фазами , т.е. равновесная концентрация компонента на входе в тарелку равна рабочей концентрации на выходе из нее. Абсорбция
Абсорбция –массообменный процесс избирательного поглощениякомпонентов газовых или парогазовых смесей жидким поглотителем. Десорбция –выделение растворенного газа из раствора,процесс,обратный абсорбции. В промышленности процессы абсорбции применяются, главным образом, для извлечения ценных компонентов из газовых смесей или для их очистки от вредных примесей. Абсорбция широко применяется в химической промышленности в производствах серной, соляной, и азотной кислот, нитратов, соды (абсорбция SO3, НСl, NO, NO2, NO3, СО2), для очистки газов от примесей, например Н2 S, СО2, SO2, СО и др., улавливания ценных компонентов из газовых смесей с целью предотвращения их потерь, например, рекуперация летучих растворителей (спиртов, эфиров, кетонов и др.). Физическая абсорбция–тип процесса абсорбции,при которомпоглощаемый компонент (абсорбтив) химически не взаимодействует с поглотителем. Химическая абсорбция (хемосорбция)-абсорбция,при которойпоглощаемый компонент химически взаимодействует с поглотителем. Абсорбент –жидкость,поглощающая газ в процессе абсорбции,например , вода, водные растворы этаноламинов, карбонатов металлов, щелочей и кислот, спирты и др. Абсорбтив –газ,который поглощается из газовой фазы жидкостью впроцессе абсорбции. Материальный баланс абсорбции – масса газа (абсорбтива) М, извлеченная из газовой смеси, равна массе газа, поглощенного абсорбентом (2.30):
где G – массовый расход инертного вещества газовой фазы, кг/с; ун, ук - концентрация распределяемого компонента в газовой фазе, кг р.к./кг ин. в-ва. L – массовый расход абсорбента, кг/с; хн , хк - начальная и конечная концентрация поглощаемого компонента в жидкой фазе, кг р.к./кг ин. в-ва. Тепловой баланс абсорбции(2.31):
где q – дифференциальная теплота абсорбции, Дж/кг; с – теплоемкость абсорбента, Дж/(кг Инверсия фаз–явление,наблюдаемое в насадочных абсорберах,когданаступает обращение фаз, т.е. жидкость становится сплошной фазой, а газ – дисперсной, сопровождается образованием газожидкостной эмульсии в режиме эмульгирования. Целью расчета абсорберовявляется определение расхода абсорбента,диаметра и высоты аппарата, его гидравлического сопротивления (2.32):
Где М – количество поглощаемого газа; Удельный расход абсорбента-величина,которая показывает,какоеколичество абсорбента подается в аппарат в расчете на 1 кг инертного вещества газовой фазы (2.33):
Диаметр и высота аппаратаопределяются аналогично общей методикерасчета массообменных аппаратов. Величина гидравлического сопротивления: 1) для пленочных абсорберов (2.34):
где Н – высота поверхности, по которой стекает пленка, м; dэ - эквивалентный диаметр канала по которому движется газ, м; Wотн – относительная скорость газа, м/с; 2) насадочных абсорберов (2.35):
где Н – высота насадки, м; dэ - эквивалентный диаметр насадки, м; W – истинная скорость газа в слое насадки, м/с; 3) тарельчатых абсорберов (2.36):
где Абсорбционные аппараты (абсорберы) –аппараты,в которыхосуществляются абсорбционные процессы. Абсорбция протекает на поверхности раздела фаз. Поэтому абсорберы должны иметь развитую поверхность контактафаз между жидкостью и газом. По способу образования этой поверхности выделяют три основные группы абсорберов: I. Поверхностные–контакт между фазами на поверхности неподвижной илимедленно текущей жидкости (туриллы, целляриусы, пластинчатые). II. Пленочные–контакт на поверхности текущей жидкой пленки(трубчатые,свосходящим движением пленки). III. Насадочные–контакт смоченной поверхности насадки(с неподвижной и«плавающей» насадками).
V. Распыливающие–тесный контакт между фазами достигается путемразбрызгивания жидкости в газовом потоке (полые, прямоточные Вентури, механические роторно-центробежные).
 Плёночным аппаратом с направленной организацией течения плёнки является – абсорбер с системой конусов (рис. 2.7). Абсорберы состоят из корпуса 1, на внутренней поверхности которого установлены неподвижные конуса 2. На валу 4 закреплены внутренние конуса 3. При вращении внутренних конусов 3, жидкость распыляется тонким слоем на неподвижные 2, образуя плёночные завесы. Прорыв газа через такие завесы приводит к образованию пены; за счёт этого увеличивается площадь контакта. Плёночным аппаратом с направленной организацией течения плёнки является – абсорбер с системой конусов (рис. 2.7). Абсорберы состоят из корпуса 1, на внутренней поверхности которого установлены неподвижные конуса 2. На валу 4 закреплены внутренние конуса 3. При вращении внутренних конусов 3, жидкость распыляется тонким слоем на неподвижные 2, образуя плёночные завесы. Прорыв газа через такие завесы приводит к образованию пены; за счёт этого увеличивается площадь контакта.
|
|||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 710. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 (2.1)
(2.1)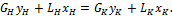 (2.2)
(2.2)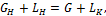 (2.3)
(2.3) (2.4)
(2.4) (2.5)
(2.5) При совместном построении линии равновесия уР и рабочей линии массообменного процесса в координатах у – х (рис. 2.4) можно установить его направление.
При совместном построении линии равновесия уР и рабочей линии массообменного процесса в координатах у – х (рис. 2.4) можно установить его направление. этого вещества.
этого вещества. или
или 
 (2.6)
(2.6) Конвективный перенос (конвективная диффузия)-процесс переноса вещества за счетперемещения его макроскопических объемов, обусловленный скоростью движущегося потока.
Конвективный перенос (конвективная диффузия)-процесс переноса вещества за счетперемещения его макроскопических объемов, обусловленный скоростью движущегося потока. (2.7)
(2.7) (2.8)
(2.8)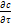 - характеризует локальное изменение концентрации распределяемого вещества во времени;
- характеризует локальное изменение концентрации распределяемого вещества во времени;  - характеризует перенос вещества за счет конвекции;
- характеризует перенос вещества за счет конвекции;  - характеризует перенос вещества в движущемся потоке за счет молекулярной диффузии.
- характеризует перенос вещества в движущемся потоке за счет молекулярной диффузии.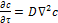 (2.9)
(2.9) (2.10)
(2.10) (2.11)
(2.11) (2.12)
(2.12) (2.13)
(2.13) (2.14)
(2.14) (2.15)
(2.15) (2.16)
(2.16) (2.17)
(2.17) ,
,  – движущие силы массоотдачи, для фазы Фy и Фx, соответственно, равные разности концентраций в ядре потока и у границы раздела фаз, или наоборот;
– движущие силы массоотдачи, для фазы Фy и Фx, соответственно, равные разности концентраций в ядре потока и у границы раздела фаз, или наоборот; 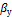 ,
,  – коэффициент массоотдачи для фазы Фy (в фазе G) и Фx (в фазе L), соответственно.
– коэффициент массоотдачи для фазы Фy (в фазе G) и Фx (в фазе L), соответственно.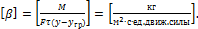 (2.18)
(2.18) (2.19)
(2.19)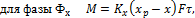 (2.20)
(2.20) ,
,  – движущие силы массопередачи, для фазы Фy и Фx соответственно, представляющие собой разность между рабочей и равновесной концентрациями распределяемого компонента в потоке данной фазы; Ку, Кх – коэффициент массопередачи для фазы Фy и Фx, соответственно.
– движущие силы массопередачи, для фазы Фy и Фx соответственно, представляющие собой разность между рабочей и равновесной концентрациями распределяемого компонента в потоке данной фазы; Ку, Кх – коэффициент массопередачи для фазы Фy и Фx, соответственно. (2.21)
(2.21) (2.22)
(2.22) (2.23)
(2.23) (2.24)
(2.24) (2.25)
(2.25) (2.26)
(2.26) (2.27)
(2.27)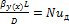 - диффузионный критерий Нуссельта, является определяемым критерием, так как включает в себя неизвестный параметр – коэффициент массоотдачи, по физическому смыслу данный критерий характеризует массоотдачу на границе раздела фаз.
- диффузионный критерий Нуссельта, является определяемым критерием, так как включает в себя неизвестный параметр – коэффициент массоотдачи, по физическому смыслу данный критерий характеризует массоотдачу на границе раздела фаз. - диффузионный критерий Фурье, характеризует подобие неустановившихся процессов массообмена;
- диффузионный критерий Фурье, характеризует подобие неустановившихся процессов массообмена;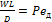 - диффузионный критерий Пекле, является мерой соотношения количества вещества, переносимого в потоке за счет конвекции, к количеству вещества, переносимому в этом же потоке за счет молекулярной диффузии.
- диффузионный критерий Пекле, является мерой соотношения количества вещества, переносимого в потоке за счет конвекции, к количеству вещества, переносимому в этом же потоке за счет молекулярной диффузии. - диффузионный критерий Прандтля, является безразмерным комплексом величин, полученным в виде отношения критерия Пекле к критерию Рейнольдса, по физическому смыслу этот комплекс характеризует физические свойства фазы.
- диффузионный критерий Прандтля, является безразмерным комплексом величин, полученным в виде отношения критерия Пекле к критерию Рейнольдса, по физическому смыслу этот комплекс характеризует физические свойства фазы.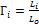 - симплекс геометрического подобия; Li - геометрический размер; Lо - определяющий размер.
- симплекс геометрического подобия; Li - геометрический размер; Lо - определяющий размер.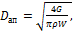 (2.28)
(2.28) - плотность сплошной фазы, кг/м3; W – допустимая скорость газа (пара), м/с; G – массовый расход сплошной фазы, кг/с.
- плотность сплошной фазы, кг/м3; W – допустимая скорость газа (пара), м/с; G – массовый расход сплошной фазы, кг/с. (2.29)
(2.29) (2.30)
(2.30) (2.31)
(2.31) К); tн, tк – начальная и конечная температура абсорбента, 0С.
К); tн, tк – начальная и конечная температура абсорбента, 0С.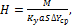 (2.32)
(2.32) - коэффициент массопередачи; a – удельная поверхность контакта фаз; S – площадь сечения колонны;
- коэффициент массопередачи; a – удельная поверхность контакта фаз; S – площадь сечения колонны;  - средняя движущая сила процесса.
- средняя движущая сила процесса. (2.33)
(2.33) (2.34)
(2.34) - плотность газа, кг/м3;
- плотность газа, кг/м3;  - коэффициент сопротивления трению;
- коэффициент сопротивления трению; (2.35)
(2.35) ( 2.36)
( 2.36) - сопротивление сухой тарелки;
- сопротивление сухой тарелки;  - сопротивление, обусловленное силами поверхностного натяжения жидкости;
- сопротивление, обусловленное силами поверхностного натяжения жидкости; 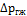 - сопротивление газо-жидкостного слоя на тарелке.
- сопротивление газо-жидкостного слоя на тарелке.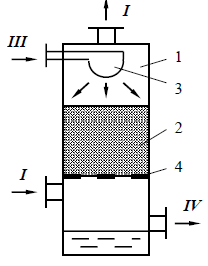 IV. Барботажные (тарельчатые)–контакт на поверхности газовых пузырькови струях (с колпачковыми, ситчатыми, клапанными и пластинчатыми тарелками со сливными устройствами и провальные).
IV. Барботажные (тарельчатые)–контакт на поверхности газовых пузырькови струях (с колпачковыми, ситчатыми, клапанными и пластинчатыми тарелками со сливными устройствами и провальные).