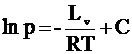Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ЗАВИСИМОСТЬ ТЕМПЕРАТУРЫ КИПЕНИЯ ВЕЩЕСТВА ОТ ДАВЛЕНИЯДавление паров жидкости с увеличением температуры возрастает. Когда оно становится равным общему давлению газов над жидкостью, начинается кипение. Иными словами, в открытом сосуде жидкость закипает, когда при нагревании (до определенной температуры, называемой температурой кипения) ее давление становится равным 760 мм рт.ст. Если в сосуде поддерживать уменьшенное давление, вещество закипит при более низкой температуре. Допустим, при комнатной температуре давление насыщенного пара соединения составляет 20 мм рт.ст. Это означает, что в вакууме, равном 20 мм рт.ст., это соединение закипит – и дальнейшее понижение давления приведет к тому, что температура кипения вещества опустится ниже комнатной. Последнее явление широко используется при сушке соединений от следов органических растворителей с использованием вакуумных установок. Исходя из тех же соображений, несложно объяснить меньшую эффективность работы водоструйных насосов летом, а также то, что минимальное давление, достигаемое с использованием этих простых приборов, составляет 5мм рт.ст. Просто таково давление паров воды, имеющей температуру 1°С. Зависимость давления паров от температуры выражается уравнением Клаузиуса - Клапейрона:
где р – давление паров; Lv – молярная теплота испарения; Т – температура (К); R –газовая постоянная
При интегрировании этого уравнения получают
Уравнение справедливо для идеальных газов, кроме того, Lv не должно меняться с температурой. Т.е. в идеальном случае в графическом представлении зависимость логарифма давления паров от обратной температуры представляет собой прямую. Наклон прямой определяется величиной Lv. Если эта величина известна, зависимость температуры кипения от давления можно рассчитать.  На основании данных о строении молекул вещества можно оценить его теплоту испарения и предсказывать температуру кипения. В некоторых пакетах химических компьютерных программ имеются соответствующие модули – например, им располагает ACD ChemSketch. Если известна температура кипения при определенном давлении, ее величину при другом давлении можно рассчитать или приблизительно определить с помощью соответствующей номограммы (рис. 24). Практически это выглядит следующим образом: на номограмму накладывают короткую линейку таким образом, чтобы она пересекала правую шкалу в точке, соответствующей известному давлению, а левую – в точке, соответствующей температуре кипения. Точка пересечения линии со средней шкалой дает приблизительную температуру кипения вещества при атмосферном давлении. Вращая линейку относительно этой точки на средней шкале, получаем значения величин температуры кипения вещества при различных давлениях.
Рисунок 24 – Номограмма давление – температура. Для очень приблизительной оценки можно руководствоваться следующим простым правилом: при уменьшении внешнего давления вдвое температура кипения понижается приблизительно на 15 °С. Содержание в парах более летучего компонента тем больше, чем сильнее различаются упругости паров чистых компонентов. Но если жидкость содержит очень малые количества более летучего компонента, он может и не являться основным компонентом газовой фазы. Если коэффициент относительной летучести достаточно велик, вещества могут быть разделены методом перегонки – постепенным нагреванием смеси соединений с отбором фракций, соответствующих разным температурам. Для эффективного разделения веществ, основанного на их различной летучести, необходимо обеспечивать равновесие между жидкой и газовой фазами. С этой точки зрения простая перегонка – процесс неравновесный, и для эффективного разделения смесей необходимо использовать ректификацию. Простая перегонка достаточно эффективна, если температуры кипения целевого соединения и примесей различаются хотя бы на 20°С – и даже в этом случае будет собрано значительное количество промежуточной фракции, содержащей оба компонента. |
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 941. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 ,
,