Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
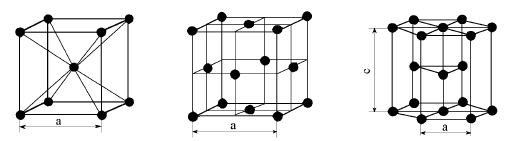
Теоретическая и реальная прочность твердых тел.Стр 1 из 20Следующая ⇒ Лекция 1 Атомно-кристаллическая структура металлов Из 106 элементов периодической системы Д.И. Менделеева 76 составляют металлы. Все металлы имеют общие характерные свойства, отличающие их от других веществ. Это обусловлено особенностями их внутриатомного строения. Согласно современной теории строения атомов каждый атом представляет сложную систему, которую схематично можно представить состоящей из положительно заряженного ядра, вокруг которого на разном расстоянии от него движутся отрицательно заряженные электроны. Притягивающее действие ядра на внешние (валентные) электроны в металлах в значительной степени скомпенсировано электронами внутренних оболочек. Поэтому валентные электроны легко отрываются и свободно перемещаются между образовавшимися положительно заряженными ионами. Слабая связь отдельных электронов с остальной частью атома и является характерной особенностью атомов металлических веществ, обусловливающей их химические, физические и механические свойства. Общее число не связанных с определенным атомом электронов в различных металлах неодинаково. Этим объясняется довольно значительное различие в степени “металличности” отдельных металлов. Наличием электронного глаза объясняют и особый тип межатомной связи, присущей металлам. Металлический тип связи характеризуется тем, что между решеткой из положительно заряженных ионов и окружающими их свободными валентными электронами возникает электростатическое притяжение. Наличие в металлах металлической связи придает им ряд характерных свойств: высокую тепло- и электропроводность; термоэлектрическую эмиссию, т.е. способность испускать электроны при нагреве; хорошую отражательную способность, т.е. обладают металлическим блеском и непрозрачны; положительный температурный коэффициент электросопротивления, т.е. с повышением температуры электросопротивление увеличивается.  Металл это вещество, имеющее металлический тип связи и положительный температурный коэффициент электросопротивления. Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, при котором энергия взаимодействия минимальна. Этому состоянию соответствует равновесноесостояние а0. Сближение атомов (ионов) нарасстояние, меньшее а0, или удаление их нарасстояние, большее а0, осуществимо лишьпри совершении определенной работы против сил отталкивания и притяжения. Поэтому вметалле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.Ее следует представлять как мысленно проведенные впространстве в направлениитрех осей координат прямые линии, соединяющие ближайшие атомы и проходящие черезих центры, около которых они совершают колебательные движения. Проведенные линииобразуют объемные фигуры правильной геометрической формы. Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, называется элементарной кристаллической ячейкой. Для металлов характерны три типа строения кристаллических решеток: 1. Кубическая объемноцентрированная (ОЦК); 2. Кубическая гранецентрированная (ГЦК); 3. Гексагональная плотноупакованная (ГПУ).
Основными характеристиками кристаллических решеток являются: 1) период решеткиа и с - расстояния между центрами ближайших атомов. Для большинства металлов период решетки составляет 0,1 - 0,7 нм; 2) координационное число- число атомов, находящихся на ближайшем и равномрасстоянии от данного атома. Чем оно выше, тем больше плотность упаковки атомов. Длякубической ячейки координационное число обозначается буквой К, а гексагональной - Г. Для ОЦК решетки минимальное расстояние между атомами равно a* . На таком расстоянии находится 8 атомов, т.е. координационное число кубической решеткиравно 8. Оно обозначается К8. Для ГПУ это расстояние равно a* , координационное число - К12.Для ГЦК отношение с/а = 1,633 и координационное число Г12; 3) базис- это количество атомов, приходящееся на одну элементарную ячейку, обозначается буквой n. На одну элементарную ячейку ОЦК приходятся 2 атома (n=2): один в центре куба, а другой вносят атомы, располагающиеся в вершинах куба. Каждый атом ввершине куба одновременно принадлежит восьми элементарным ячейкам, примыкающимк нему, и на одну ячейку приходится лишь 1/8 часть атома. В целом на каждую ячейкуприходится n = (1/8)*8 =1 атом. Координационное число считается для центрального атома и соответствует К8. На одну элементарную ячейку ГЦК приходится 4 атома (n=4), из них один вносятатомы в вершинах куба, а три суммарно вносят атомы, находящиеся на середине грани,так как каждый их таких атомов принадлежит двум ячейкам (1/2)*6 =3. Координационноечисло считается для атома, расположенного в центре грани, и соответствует К12. На одну элементарную ячейку ГПУ приходится шесть атомов (n=6), из них три находятся внутри ячейки. Два атома в центре граней дают один атом ((1/2)*2 =1), а двенадцать вершинных атомов - два атома ((1/6)*12 =2). Координационное число считается для атома, расположенного внутри ячейки, и соответствует Г12.
Теоретическая и реальная прочность твердых тел.
Прочность — способность тела (металла) сопротивляться деформациям и разрушению. Большинство технических характеристик прочности определяют в результате статического испытания на растяжение. В1910-х годах ХХ века, когда по данным различных физических методов (спектроскопических, акустических, калориметрических) были определены силы межатомного сцепления, по этим характеристикам для совершенных (бездефектных) кристаллических решеток была рассчитана прочность на разрыв, которая и получила название теоретической прочности. Теоретическая прочность металлов, определяемая силами межатомной связи в кристаллической решетке, в сотни и тысячи раз превышает их техническую (реальную) прочность. Сопротивление отрыву для железа, по данным различных авторов, теоретическое - 12 000 - 100 000 МПа, реальное - 300 МПа. Теоретическая прочность соответствует идеальной бездефектной кристаллической решетке металла. При определенном числе дефектов металл имеет минимальную прочность (точка 1). С уменьшением числа дефектов прочность возрастает. Прочность нитевидных бездислокационных кристаллов «усов» приближается к теоретической. Они имеют почти идеальную поверхность без шероховатостей (не обнаруживается при увеличениях в десятки тысяч раз). Они представляют собой монокристаллы, выращенные в специальных условиях методом разложения или восстановления соответствующих химических соединений, путем конденсации паров чистых металлов при соответствующих температурах в среде водорода или инертного газа, или методом электроосаждения металлов из растворов на очень маленькие электроды. Размеры нитевидных кристаллов находятся обычно в пределах от 2 до 10 мм в длину и от 0,05 до 5 мкм в толщину.
Так, «ус» железа толщиной 1 мкм имеет предел прочности порядка 13 500 МПа, т.е. почти теоретическую прочность, однако пока длина «усов» не превышает 15 мм и практическое применение их ограничено, например, армированием сапфировыми или графитовыми усами тугоплавких металлов.
С увеличением числа дефектов (правее точки 1) прочность металлов возрастает. Возникающие в реальных плоскостях и направлениях дислокации будут мешать друг другу перемещаться, что потребует приложения больших напряжений. Движение дислокаций могут тормозить различные препятствия: границы зерен в поликристаллах, границы блоков. Поэтому мелкозернистая сталь прочнее крупнозернистой. Широко известны способы упрочнения, ведущие к увеличению полезной плотности дислокаций, такие как механический наклеп, термическая обработка, легирование (внедрение в решетку чужеродных атомов, создающих всякого рода несовершенства и искажение кристаллической решетки), создание структуры с так называемыми упрочняющими фазами, вызывающими дисперсионное твердение. Если число дефектов будет превышать значение, соответствующее точке 2, то прочность резко падает, т.к. многочисленные дислокации, сливаясь друг с другом, образуют трещины.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 712. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |