
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Лабораторная работа «Методика определения содержания хлорид-ионов в почве»Цель работы:ознакомиться с методикой определения хлорид-ионов в почве и овладеть практическими навыками применения метода Мора. Реактивы и оборудование: конические колбы на 200 мл; пипетки на 10 мл; цилиндры мерные на 100 мл; бюретки для титрования; дистиллированная вода; 0,01 н раствор AgNO3: растворяют 1,6987 г AgNO3 в дистиллированной воде; 0,01 н раствор NaCI, готовится из фиксанала; 5 %-ный раствор К2СrО4.
Общие положения.Под засолениемпонимают процесс накопления солей нитратов, карбонатов, хлоридов, сульфатов)в почве. В результате засоления образуются солонцеватые и солончаковые почвы. К засоленным почвам относятся те почвы, содержание солей в которых превышает 0,25 % по массе. Процесс засоления почв происходит под действием антропогенных факторов за счет избытка поступления воды с водосборных и дренажных сетей, а также при разливе пластовых высокоминерализованных вод. Засоление почв также может происходить и в естественных условиях за счет поднятия соленых и солоноватых вод. Увеличение концентраций солей в почвенном покрове является причиной невозможности роста растений. Большую роль в техногенных потоках имеют водорастворимые хлориды, в меньшей степени – карбонаты и сульфаты. Засоление почвенного покроваприводит к созданию низкого водного потенциала, в связи с этим нарушается поступление воды в растение. Наличие солей в почве ведет к нарушению процессов обмена. Определение хлорид-ионов ведется по методу Мора. Принцип метода Мора основан на осаждении хлоридов азотнокислым серебром в присутствии хромата калия. При наличии в растворе хлорид-ионов азотнокислое серебро связывается с ними и образует хромат серебра оранжево-красного цвета:  NaCI + AgNO3 →AgCI↓+ NaNO3 2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3
Ход работы.В коническую колбу на 200 мл вносят 10 мл анализируемого раствора и 90 мл дистиллированной воды. Затем добавляют 5 капель хромата калия. Содержимое колбы титруют раствором азотнокислого серебра до перехода лимонно-желтой окраски в оранжево-красную, не исчезающую в течение 15 – 20 с. Титрование выполняют в нескольких параллелях и берут среднее значение. При содержании хлорид-ионов менее 250 мг/л берут 100 мл фильтрованной испытуемой воды. Концентрация хлорид-ионов в анализируемом растворе рассчитывается по формуле 4.3:
где X– содержание хлорид-ионов, мг/л; V–объем раствора азотнокислого серебра, пошедший на титрование, мл; 35,5– эквивалентное количество хлора, соответствующее 1 мл 0,01 н раствора азотнокислого серебра, мг.
Контрольные вопросы: 1. С помощью какого метода ведется определение хлорид-ионов? 2. На чем основан принцип метода Мора? 3. Какой химический реактив используется в качестве индикатора? 4. Опишите методику определения хлорид-ионов в почве. Лабораторная работа «Методика определения содержания ионов кальция и магния в почве» Цель работы: ознакомиться с методикой определения ионов кальция и магния в почве и овладеть практическими навыками применения комплексонометрического метода. Реактивы и оборудование:раствор трилона Б с молярной концентрацией эквивалента 0,05 моль/л; индикатор хромоген черный; раствор гидроксида натрия с молярной концентрацией 2 моль/л; аммонийный буферный раствор; индикатор мурексид с хлоридом натрия.
Общие положения.По абсолютной концентрации в почвенном покрове кальций и магний входят во вторую группу элементов, содержание которых изменяется от десятых долей до нескольких процентов. Чаще всего их содержания достаточно для удовлетворения потребностей растений, и эти элементы, особенно кальций, не считаются удобрительными. Среднее содержание кальция в литосфере – 3,6 %, магния – 2,1 %, однако в дерновоподзолистых почвах их содержание в 3 – 9 и 2–7 раз меньше соответственно. Кальций и магний входят в состав значительного количества горных пород. Большая их часть находится в виде труднорастворимых соединений, но при почвообразовательных процессах они переходят в более растворимые формы, которые могут быть потреблены растениями в процессе роста. Кальций и магний обычно встречаются в почве и растениях в виде двухвалентного катиона. Наиболее доступными для растений являются обменопоглощенные почвенными коллоидами ионы этих элементов. Так, на дерновоподзолистой почве содержание обменного кальция в пахотном слое составляет 500–1000 мг/кг почвы или 20–30 % от валового, магния – 100–300 мг/кг почвы или 5–10 % от валового. В даннойлабораторной работе используется комплексонометрический метод определения ионов кальция и магния при их совместном присутствии в растворе. Сущность методасостоит в определении суммарного содержания ионов кальция и магния в результате титрования анализируемого фильтрата раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л в присутствии индикатора хромогена черного. Затем находят содержание ионов кальция, титруя исследуемый фильтрат раствором трилона Б в присутствии индикатора мурексида с хлоридом натрия. По разности этих двух определений находят содержание ионов магния.
Ход работы. Определение суммарного содержания ионов кальция и магния.В коническую колбу вносят 50 мл анализируемого раствора и добавляют 5 мл аммонийной буферной смеси, 25 – 30 мг хромогена черного и титруют раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до перехода винно- красной окраски раствора в синюю. Титрование выполняют в трех параллелях и берут среднее значение. Суммарное содержание ионов кальция и магния определяют по формуле 4.4:
где С(1/zNа2[НзТr]) – концентрация раствора трилона Б, н; V(Na2[НзТr])– объем рабочего раствора трилона Б, затраченного на титрование, мл; Vф – объем фильтрата, мл.
Определение содержания ионов кальция.В коническую колбу вносят 50 мл анализируемого раствора и добавляют2,5 мл раствора гидроксида натрия с молярной концентрацией 2 моль/л, 30 – 40 мг смеси мурексида с хлоридом натрия и приступают к титрованию раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до появления сине-фиолетовой окраски, не исчезающей в течении 2 – 3 минут. Титрование выполняют в нескольких параллелях и берут среднее значение. Содержание кальция вычисляют по формуле 4.5:
Количество ионов магния находят по формуле 4.6:
m(Mg2+) = m(Ca2++Mg2+) – m(Ca2+) (4.6)
Конрольные вопросы: 1. В чем заключается сущность комплексонометрического метода? 2. По какой формуле определяется суммарное содержание ионов кальция и магния? 3. Какова последовательность определения суммарного содержания ионов кальция и магния в почве? 4. По какой формуле рассчитывается количество магния? 5. Каким образом осуществляется определение содержания ионов кальция? |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 900. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
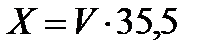 (4.3)
(4.3) (4.4)
(4.4) (4.5)
(4.5)