
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение природы электродных процессов, лимитирующего токаВажной характеристикой при протекании электрохимической реакции является природа электродного процесса. Общая электрохимическая реакция Ох + nе ↔ Red состоит из ряда этапов, которые вызывают превращение окисленных формы Ох в восстановленную форму Red. Механизм переноса электронов с медиатора на электрод состоит из нескольких стадий, таких как: 1. Массоперенос (диффузия, миграция или конвекция). 2. Электронный перенос на поверхности электрода с участием медиатора. 3. Химические реакции (гомогенные процессы – протонирование или димеризация, или гетерогенные – каталитическое разложение) на поверхности электрода. 4. Другие поверхностные реакции, такие как адсорбция, десорбция или кристаллизация. Для систем, в которых электрохимический перенос электронов лимитируется диффузией, предельный катодный и предельный анодные токи должны быть пропорциональны корню квадратному из скорости развертки потенциала, в соответствии с уравнением Рэндлса-Шевчика [4]:
где А - площадь электрода (см2), R – универсальная газовая постоянная (Дж·моль/K), Т - температура (K), n – число участвующих электронов, α- коэффициент переноса электронов, ν-скорость развертки (В), D- коэффициент диффузии. На рис. 4. представлены графики зависимости анодного тока от квадратного корня скорости развертки потенциала для процессов окисления тионина на угольно-пастовом электроде.
Рис. 4. Зависимость Ia от ν1/2 для процессов окислениятионина на угольно-пастовом электроде.
Данные зависимости нелинейны, следовательно, процесс не определяется диффузией медиатора к поверхности электрода. Если прологарифмировать уравнение, то можно перейти к уравнению: 
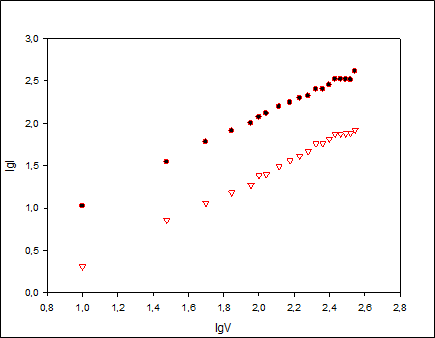
Наклон графика зависимости lgiaот lgν дает х, который называется коэффициентом скорости или критерием Семерано. Для диффузионных процессов величина х должна составлять 0,5[3]. На рис. 5. представлены зависимости логарифма силы тока от логарифма скорости развертки потенциала окисления и восстановления 2,6-дихлорфенолиндофенола и тионинана угольно-пастовом электроде.
Рис. 5. Зависимость lgI от lgv окисления и восстановления2,6-дихлорфенолиндофенола и тионина на угольно-пастовом электроде.
Для электрохимических системах в отсутствии диффузии, то есть когда электроактивные молекулы адсорбированы на электроде или в процесс протекает вблизи поверхности электрода, то тогда сила тока линейно зависит от скорости развертки потенциала и можно выразить с помощью уравнения:
где Г0 –поверхностная концентрация электроактивного вещества на электроде (моль/см2), ν -скорость развертки потенциала (В/с), А– площадь электрода (см2), R – универсальная газовая постоянная (Дж·моль/K), Т – температура (K), n – число участвующих электронов. При построении зависимости предельного тока от скорости развертки потенциала график будет иметь прямолинейный характер, это будет свидетельствовать о вкладе адсорбции на электрохимический процесс. На рис. 6. представлены графики зависимости анодного и катодного тока от скорости развертки потенциала для процесса окисления нейтрального красного на угольно-пастовом электроде.
Рис. 6 Зависимость Iaи Iк от νдля процессов окисления нейтрального красного на угольно-пастовом электроде. Как видно из полученных зависимостей (рис. 6), что отношение предельного тока окисления нейтрального красного от скорости развертки потенциала имеет линейный вид. Из этого можно сделать вывод, что лимитирующей стадией при электрохимическом процессе является адсорбция. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 860. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
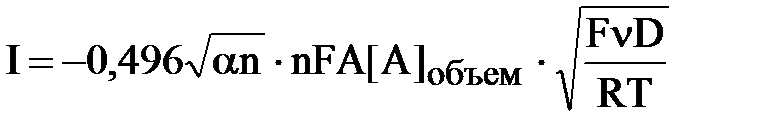 ,
,



 ,
,