
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Зависимость скорости реакции от концентрации веществЧтобы произошла реакция, необходимо столкновение реагирующих частиц. Число столкновений растет с увеличением числа реагирующих частиц в единице объема, т.е. с увеличением концентрации веществ. Это утверждение нашло отражение в законе действующих масс, который установили в 1867 г. норвежские химики К.Гульдберг и П. Вааге: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Для реакции bB + dD = lL + mM выражение кинетического уравнения скорости имеет вид где k – константа скорости реакции, не зависит от концентрации веществ, но зависит от их природы и температуры; b и d –порядки реакции, установленные опытным путем (для простых реакций совпадают со стехиометрическими коэффициентами в уравнении), сА и сВ – концентрации реагентов. Закон действующих масс справедлив лишь для наиболее простых по своему механизму реакций, протекающих в газах или растворах. Часто уравнение реакции не отражает ее механизма. Сложные реакции можно представить как совокупность простых процессов, протекающих последовательно или параллельно. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальна, лимитирует (определяет) скорость реакции, в общем. Поэтому закон действующих масс для лимитирующей стадии процесса приложим и ко всей реакции в целом. Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
10 вопрос |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 210. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
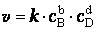 ,
,