
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Кроме таблиц (баз данных) по энтальпиям (теплотам) образованияХимических соединений составлены также (особенно для органических веществ) аналогичные таблицы по теплотам (энтальпиям) сгорания. (∆ сH 0 A Индекс с – от combustion, сгорание) Таким образом, мы рассмотрели первую задачу, которую поставили При начале обсуждения темы – задачу об энергетике химических реакций. Вопрос Второе начало термодинамики: формулировки Клаузиуса и Томсона. Свободная и связанная энергия.
Второе начало термодинамики · Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса). · Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона). Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.  Таким образом, постулаты Клаузиуса и Томсона эквивалентны. Он имеет много формулировок, первую из которых дал Клаузиус в 1850 году, однако для нас будет важна такая: Лебедев Ю.А. Лекция 8 В изолированных системах самопроизвольно протекают только Процессы, не сопровождающиеся уменьшением энтропии. 14 Математически это записывается так: dSad ≥ 0 (Здесь индекс ad означает адиабатический процесс). Равенство нулю возможно при обратимом проведении циклических Процессов. Следует подчеркнуть, что действие Второго Начала термодинамики Строго ограничено ТОЛЬКО изолированными системами. А вот понятие Энтропии, которое породило этот закон, применимо ко всем видам Термодинамических систем и играет важную роль в понимании хода всех Термодинамических процессов. И вне рамок адиабатических процессов энтропия, по физическому Смыслу представляющая хаос, если в системе ей не противостоит какая-то Противодействующая причина, стремится к возрастанию. Вопрос Энтропия с точки зрения классической термодинамики (энтропия как мера связанной энергии). Определение энтропии, расчет энтропии веществ в различных процессах (изотермический, изобарный, изохорный), стандартная энтропия, расчет DS химической реакции.Свойства энтропии. Понятие энтропии. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 210. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
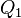 у нагревателя, отдав
у нагревателя, отдав  холодильнику и совершив при этом работу
холодильнику и совершив при этом работу  . После этого воспользуемся процессом Клаузиуса и вернем тепло
. После этого воспользуемся процессом Клаузиуса и вернем тепло