
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Минеральным веществам так же можно разделить на макроэлементы и микроэлементы. ⇐ ПредыдущаяСтр 6 из 6 Макроэлементы – натрий, калий, кальций, магний, фосфор, хлор, сера – содержатся в организме в высоких концентрациях. Микроэлементы – железо, медь, марганец, цинк, кобальт, йод, фтор, хром, молибден – в небольших концентрациях. Элементы в периодической таблице делятся на s-, p и d-элементы. К блоку s-элементов относятся 13 элементов, находящихся в I и II группах главных подгруппах. Электронные структуры у этих элементов заполнены таким образом, что валентные электроны ( один или два) расположены нам внешнем s-подуровне, а предпоследний энергетический слой состоит из устойчивой восьми электронной оболочки ( исключение составляют водород и гелий, у которых всего один электронный слой). s-Элементы , содержащие один валентный электрон относятся к группе IА, а s-элементы, которые имеют два валентных электрона, составляют IIА группу. Степень окисления этих элементов равна номеру группы. Из-за сходного строения электронной оболочки, s-элементы каждой группы обладают сходными свойствами. Для характеристики свойств элементов пользуются такими физическими единицами, как атомные и ионные радиусы, энергия ионизации, сродство к электрону, электроотрицательность. При увеличении радиуса в группах сверху вниз связь валентного электрона с ядром ослабевает и уменьшается энергия ионизации. Атомы щелочных и щелочно-земельных элементов легко отдают свой валентный электрон, что характеризует их как сильные восстановители. Значение величин электроотрицательностей определяет форму существования элемента в живых системах. Так, s-элементы I группы характеризуются соответственно очень низкими значениями электроотрицательности, поэтому в живых организмах они находятся в виде катионов. Так, ион Na - основной катион внеклеточных жидкостей, а ионы K-внутриклеточные катионы. Кальций и магний содержатся в костной и зубной тканях в виде катионов малорастворимых солей  К р-элементам относятся 30 элементов III-VIIА – групп периодической системы. р-Элементы расположены во втором и третьем малых периодах, а также в четвертом – шестом больших периодах. Элементы IIIА- группы имеют5 один электрон на р-орбитали. В IVА- VIIА-группах наблюдается заполнение р- подуровня до 6 электронов. В периодах при увеличении заряда ядра атомные и ионные радиусы р-элементов уменьшаются, энергия ионизации и сродство к электрону возрастает, электроотрицательность увеличивается, окислительная активность соединений и неметаллические свойства элементов усиливаются. В группах с возрастанием порядкового номера элемента радиусы атомов и однотипных ионов¸ как правило, увеличиваются, неметаллические свойства ослабевают, а металлические - усиливаются. На свойства р-элементов и их соединений влияют как появление новых подуровней на внешнем электронном уровне, так и заполнение подуровней внутренних электронных слоев. Свойства р-элементов второго периода - В, С, N, О, F― резко отличаются от свойств элементов других периодов. Так, начиная от р-элементов третьего периода, появляется свободный d-подуровень, на который могут переходить электроны с s- и р-подуровней при возбуждении атомов. р-Элементы II периода – азот, кислород и фтор – Проявляют ярко выраженную способность участвовать в образовании водородных связей. Элементы третьего и следующих периодов это свойство теряют. Особенности d-элементовопределяются электронным строением их атомов: во внешнем электронном слое содержится, как правило, не более 2 s-электронов, р-подуровень свободный, происходит заполнение d-подуровня предвнешнего уровня. Свойства простых веществ d-элементов определяется в первую очередь структурой внешнего слоя, и лишь в меньшей степени зависят от строения предшествующих электронных слоев. Невысокие значения энергии ионизации этих атомов указывают на сравнительно слабую связь внешних электронов с ядром. Это определяет их общие физические и химические свойства, исходя из которых следует отнести простые вещества d-элементов к типичным металлам. Для V, Cr, Mn, Fe, Co энергия ионизации составляет соответственно от 6,74 до 7,87 эв. Именно поэтому переходные элементы в образуемых ими соединениях проявляют только положительную степень окисления и проявляют свойства металлов. Большая часть d-элементов – это тугоплавкие металлы. По химической активности d-элементы весьма разнообразны. Такие как Sc, Mn, Zn наиболее химически активны (как щелочноземельные). Наиболее химически устойчивы Au, Pt, Ag, Сu. В 1 ряду инертны Ti, Сr. В семействе Sc, Zn и наблюдается плавный переход в изменении химических свойств слева направо, так как возрастание порядкового номера не сопровождается существенным изменением структуры внешнего электронного слоя, происходит только достройка d-подуровня предпоследнего уровня. Поэтому химические свойства в периоде хотя и закономерно, но гораздо менее резко изменяются, чем у элементов А групп, в которых ряд начинается активным металлом и заканчивается неметаллом. По мере увеличения заряда ядра d-элементов слева направо возрастает энергия ионизации, необходимая для отрыва электрона. В пределах одного семейства (декады) устойчивая максимальная степень окисления элементов сначала возрастает, благодаря увеличению числа d-электронов, способных участвовать в образовании химических связей, а затем убывает (вследствие усиления взаимодействия d-электронов с ядром по мере увеличения его заряда). Так максимальная степень окисления Sc, Ti, V, Сr, Mn совпадает с номером группы, в которой они находятся, у последнего не совпадает, для Fe равна 6, для Со, Ni, Сu -3, а для Zn -2 и соответственно меняется устойчивость соединений, отвечающих определенной степени окисления. В степени окисления +2 оксиды TiO и VО – сильные восстановители, неустойчивы, а СuО и ZnO не проявляют восстановительных свойств и устойчивы. Водородных соединений не образуют. К d-элементам относятся32 элемента периодической системы IV- VII больших периодов. В III В - группе у атомов появляется первый электрон на d- орбитали, в последующих В-группах d-подуровень заполняется до 10 электронов. В периодах с возрастанием заряда ядра увеличение радиуса атомов происходит довольно медленно, непропорционально числу электронов, заполняющих оболочку атомом. Такое «непропорциональное» изменение радиусов объясняется лантаноидным сжатием, а также проникновением ns- электронов на d-электронный слой (действует принцип наименьшей энергии). Атомные радиусы переходных элементов значительно меньше радиусов s- и р- металлов того же периода. Особенности химических свойств d-элементов позволяют рассматривать их как единую группу. К этим особенностям относятся следующие: 1. Все d-элементы отличаются от s-элементов меньшей восстановительной способностью и большей химической инертностью. 2. Для большинства d-элементов характерно проявление двух и больше степеней окисления, почти одинаковых по термодинамической стойкости в обычных условиях, т.е. характерно большое разнообразие окислительно- восстановительных реакций. 3. Соединения многих d-элементов в высших степенях окисления проявляют кислотные, а в низших - слабоосновные свойства. 4. Наиболее характерной особенностью d-металлов является способность образовывать разнообразные комплексные соединения, многие из которых устойчивы в водных растворах. С увеличением порядкового номера элемента устойчивость его высшей степени окисления в периоде уменьшается, а в группе возрастает. Снижение устойчивости высшей степени окисления в периоде обусловлено эффектом d-6 сжатия. В побочных подгруппах сверху вниз уменьшаются металлические и восстановительные свойства элементов. В растворах d-элементы в высшей степени окисления представлены анионами, обычно кислородсодержащими. При этом соединения в высшей степени окисления проявляют кислотные и окислительные свойства. d-Элементы, имеющие невысокие значения электроотрицательности, склонны существовать в биосистемах в виде катионов и проявляют основные свойства. Амфотерные свойства характерны для соединений в промежуточных степенях окисления. d-Элементы относятся к микроэлементам. Среди них незаменимые в основном элементы IVпериода; Mn, Fe, Zn, Cu, Co. Установлена физиологическая роль и некоторых других d-элементов этого периода: Ti, Cr, V. В организмах микроэлементы могут находиться как в связанном состоянии, так и в виде свободных ионных форм. Установлено, что кремний, алюминий, медь и титан в тканях головного мозга находятся в виде комплексов с белками, тогда как марганец – в ионном виде. Элементы, содержание которых не превышает 10-3%, входят в состав ферментов, гормонов, витаминов и других жизненно важных соединений. Для белкового, углеводного и жирового обмена веществ необходимы: Fe, Co, Mn, Zn, Мо, V, В, W; в синтезе белков участвуют: Mg, Мn, Fe, Со, Си, Ni, Сr, в кроветворении – Со, Ti, Си, Mn, Ni, Zn ; в дыхании - Mg, Fe, Сu, Zn, Mn и Co. Поэтому микроэлементы нашли широкое применение в медицине, в качестве микроудобрений для полевых культур, подкормки в животноводстве, птицеводстве и рыбоводстве. Микроэлементы входят в состав большого числа биорегуляторов живых систем, в основе которых лежат биокомплексы. Ферменты – это особые белки, которые действуют как катализаторы в биологических системах. Ферменты – уникальные катализаторы, обладающие непревзойденной эффективностью действия и высокой селективностью. Все р-элементы и в особенности р-элементы второго и третьего периодов (С, N, Р, О, S, Si, Cl) образуют многочисленные соединения между собой и с s-, d- и f-элементами. Большинство известных на Земле соединений – это соединения р-элементов. Пять главных (макробиогенных) р-элементов жизни – О, Р, С, N и S – это основной строительный материал, из которого сложены молекулы белков, жиров, углеводов и нуклеиновых кислот. Из низкомолекулярных соединений р-элементов наибольшее значение имеют оксоанионы: СО32-, НСО3-, С2O42-, СНзСОО-, РО43-, НРO42-, H2PO4-, SO42- и галогенид-ионы. р-Элементы имеют много валентных электронов, обладающих различной энергией. Поэтому в соединениях проявляют различную степень окисления. Например, углерод проявляет различные степени окисления от – 4 до +4. Азот – от -3 до +5, хлор – от -1 до +7. 12. Аналитическая химия. Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ; имеет целью определение элементов или групп элементов, входящих в состав различных веществ. Предмет её как науки — совершенствование существующих и разработка новых методов анализа, их практическое применение, исследование теоретических основ аналитических методов качественный и количественный анализ. Цель качественного анализа—определение; элементного или изотопного состава вещества. При анализе органических соединений находят непосредственно отдельные химические элементы, например углерод, серу, фосфор, азот или функциональные группы. При анализе неорганических соединений определяют, какие ионы, молекулы, группы атомов, химические элементы составляют анализируемое вещество.
Цель количественного анализа—установление количественного соотношения составных частей вещества. По результатам коли-
чественного анализа можно определить константы равновесия, произведения растворимости, молекулярные и атомные массы. Количественному анализу обычно предшествует качественный анализ. Условия выполнения При выполнении аналитических реакций в качественном анализе необходимо соблюдать следующие требования: • создание и поддержание в ходе реакций определенного значения рН раствора; • создание определенной концентрации реагирующих веществ. Одним из важных требований к аналитическим реакциям является их высокая чувствительность. Чувствительностью реакции называют самую малую концентрацию ионов, которую можно открыть с помощью данной реакции при определенных условиях ее выполнения. Качественные реакции:
Гидрофосфат натрия в присутствии NH4OH и NH4Cl образует с солями магния белый кристаллический осадок фосфата магния-аммония: MgCl2 + Na2HPO4 + NH4OH ¾® NH4MgPO4↓ + H2O + 2NaCl. Нитраты в растворе не проявляют окислительных способностей. Но при подкислении раствора способны окислить, к примеру, медь (раствор подкисляют обычно разб. H2SO4): 3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO↑ + 4H2O Аналитическиереакции можно проводить "сухим" и "мокрым" путём. Так, реакции окра- шивания пламени (Na − жёлтый; Sr − красный; Ba − зелёный), образование окрашенных "перлов" буры осуществляются "сухим" путём. Чаще всего аналитические реакции проводят в растворах. Анализи- руемый объект (индивидуальное вещество или смесь веществ) может на- ходиться в любом агрегатном состоянии (твёрдом, жидком, газообраз- ном). Объект для анализа называется образцом или пробой. Один и тот же элемент в образце может находиться в различных химических формах. Например: S , S , SO4,SO3 и т.д. В зависимости от цели и задачи анализа после переведения в раствор пробы проводят элементный анализ8 (определение общего содержания серы) или фазовый анализ (определение содержания серы в каждой фазе или в её отдельных химических формах). Выполняя ту или иную аналитическую реакцию, необходимо строго соблюдать определённые условия её протекания (температура, рН раствора, концентрация) с тем, чтобы она протекала быстро и имела достаточно низкий предел обнаружения при титриметрическом анализеизмеряют объем затрачиваемого на ее проведение раствора реагента, концентрация (или, как говорят, титр) которого всегда точно известна. Таким образом, в титриметрическом (объемном) анализе количественное определение химических веществ осуществляется чаще всего путем точного измерения объемов растворов двух веществ, вступающих между собой в реакцию титром обычно понимают число граммов или миллиграммов растворенного вещества, содержащееся в 1 мл раствора. титрование – постепенное смешивание веществ до полного окончания реакции Точкой эквивалентностиназывается момент, наступающий в ходе титрования, когда реагирующие вещества полностью прореагировали. В этот момент они находятся в эквивалентных количествах, т.е. достаточных для полного, без остатка, протекания реакции Первичным стандартом называется раствор с точно известной концентрацией, приготовленный по точной навеске вещества. Вещество для приготовления первичного стандарта должно иметь определённый состав и быть определённой степени чистоты Вторичным стандартом называется раствор вещества с точно известной концентрацией, которая устанавливается по первичному стандарту. Индикаторы в методе нейтрализации, представляют собой органические соединения, окраска которых меняется в зависимости от конецентраций ионов водорода в растворе. Это так назхываемые кислотно-основные индикаторы, или pH-индикаторы. Индикаторы метода нейтрализации характеризуются так называемым интервалом перехода. Под этим понимают значение рН раствора, в пределах которых данный индикатор меняет свою окраску. Это значит, что в тех растворах, в которых рН равно или меньше 3 1, индикатор имеет розовый цвет. Растворы же, рН которых равен или больше 4 4, окрашиваются индикатором в желтый цвет. Растворы, рН которых меньше 4 4, но больше 3 1, окрашиваются метилоранжевым в оранжевый цвет. Развитие комплексонометрии связано с открытием так называемых металлоиндикаторов – веществ, образующих с ионами металлов интенсивно окрашенные соединения. С использованием индикаторов такого типа титрование можно проводить в щелочной среде (как правило, его осуществляют в аммиачном буферном растворе), связывая выделяющиеся ионы водорода и смещая вправо равновесие реакции комплексообразования между определяемым катионом и анионом ПЕРМАНГАНАТОМЕТРИЯ– метод объемного (титриметрического) химического анализа, основанный на применении стандартного (имеющего строго определенную концентрацию) раствора перманганата калия KMnO4. При действии восстановителей перманганат-ион в кислотной среде переходит в бесцветный катион марганца(2+): Физико-химические методы анализа, основаны на зависимости физических свойств вещества от его природы, причем аналитический сигнал представляет собой величину физического свойства, функционально связанную с концентрацией или массой определяемого компонента. Физико-химические методы анализа могут включать химические превращения определяемого соединения, растворение образца, концентрирование анализируемого компонента, маскирование мешающих веществ и других. В отличие от «классических» химических методов анализа, где аналитическим сигналом служит масса вещества или его объем, в физико-химические методы анализа в качестве аналитического сигнала используют интенсивность излучения, силу тока, электропроводность, разность потенциалов и др. ФОТОМЕТРИЧЕСКИЙ АНАЛИЗ (ФА), совокупность методов мол.-абсорбционного спектрального анализа, основанных на избират. поглощении электромагн. излучения в видимой, ИК и УФ областях молекулами определяемого компонента или его соед. с подходящим реагентом. Концентрацию определяемого компонента устанавливают по закону Бугера -Ламберта - Бера (см. Абсорбционная спектроскопия). ФА включает визуальную фотометрию (см. Колориметрический анализ), спектрофотометрию и фотоколориметрию. Последняя отличается от спектрофотометрии тем, что поглощение света измеряют гл. обр. в видимой области спектра, реже - в ближних УФ и ИК областях (т. е. в интервале длин волн от ~ 315 до ~ 980 нм), а также тем, что для выделения нужного участка спектра (шириной 10-100 нм) используют не моно-хроматоры, а узкополосные светофильтры. БУГЕРА - ЛАМБЕРТА - БЕРА ЗАКОН - определяет ослабление пучка монохроматич. света при его распространении через поглощающую среду, в частном случае - через раствор поглощающего вещества в непоглощающем растворителе. Пучок монохроматич. света интенсивностью I0, пройдя через слой поглощающего вещества толщиной l, выходит ослабленным до интенсивности I, определяемой выражением Применительно к поглощению света растворами поглощающих веществ в непоглощающих растворителях показатель поглощения в Б--Л--Б. з. может быть записан в виде
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 188. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
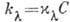 , где С - концентрация растворённого вещества, а
, где С - концентрация растворённого вещества, а 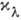 - коэф., не зависящий от С и характеризующий взаимодействие молекулы поглощающего вещества со светом с длиной волны
- коэф., не зависящий от С и характеризующий взаимодействие молекулы поглощающего вещества со светом с длиной волны 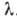 . Утверждение, что
. Утверждение, что 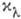 не зависит от С, наз. законом А. Бера (А. Вееr, 1852), и его смысл состоит в том, что поглощающая способность молекулы не зависит от влияния окружающих молекул. Закон этот надо рассматривать скорее как правило, т. к. наблюдаются многочисл. отступления от него, особенно при значит. увеличении концентрации поглощающих молекул. В тех случаях, когда
не зависит от С, наз. законом А. Бера (А. Вееr, 1852), и его смысл состоит в том, что поглощающая способность молекулы не зависит от влияния окружающих молекул. Закон этот надо рассматривать скорее как правило, т. к. наблюдаются многочисл. отступления от него, особенно при значит. увеличении концентрации поглощающих молекул. В тех случаях, когда 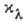 можно считать не зависящим от С, Б--Л.- Б. з. оказывается полезным для определения концентрации поглощающего вещества путём измерения поглощения. Этим приёмом пользуются для быстрого измерения концентраций веществ, хим. анализ к-рых оказывается сложным.
можно считать не зависящим от С, Б--Л.- Б. з. оказывается полезным для определения концентрации поглощающего вещества путём измерения поглощения. Этим приёмом пользуются для быстрого измерения концентраций веществ, хим. анализ к-рых оказывается сложным.