Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Рассеяние света, окраска коллоидовКоллоидные растворы обладают оптическими свойствами, отличными от таковых у истинных растворов и грубодисперсных систем. Проходя через дисперсную систему, свет может поглощаться, отражаться и рассеиваться. Отражение света происходит в тех случаях, когда размер частиц больше, чем длина волны падающего света, таким образом, отражать свет могут только грубодисперсные системы. Коллоидные системы содержат частицы с диаметром намного меньшим, чем длина волны падающего света, поэтому в коллоидных системах происходит только рассеяние света. Устойчивость коллоидов Коллоидную систему называют устойчивой, если она не изменяет во времени степени дисперсности и концентрации мицелл по объему системы. Установлено, что лиофильные коллоиды значительно устойчивее, чем лиофобные. Термодинамическая устойчивость лиофильных коллоидов (жидкие растворы), а также их разновидности — «лиофильных суспензоидов» (мыла, глины) определяется тем, что величина свободной энергии системы при диспергировании уменьшается. Это связано с тем, что диспергирование ведет систему к более вероятному состоянию — равномерному распределению дисперсной фазы по всей системе, энтропийный фактор растет, и это уменьшает свободную энергию системы, увеличивая ее термодинамическую стабильность:
В случае лиофобных коллоидов (жидкие растворы) знак свободной энергии системы определяет энтальпийный (а не энтропийный) фактор, так как при образовании лиофобного коллоида очень велики энергетические затраты на его диспергирование:
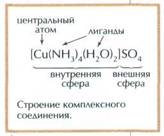
9. Комплексные соединения. Координационными называют соединения, содержащие в одном из агре-  гатных состояний группу ионов или нейтральных молекул (лигандов), в опре- деленном порядке размещенных (координированных) вокруг центрального атома (иона) – комплексообразователя, в качестве которого в большинстве случаев выступает атом металла. 1. Координационные соединения характеризуются явлением координа- ции, т.е. четко фиксируемым геометрическим расположением частиц (атомов, молекул, ионов) одного вида вокруг другого – атомов, ионов, выступающих в роли комплексообразователей. 2. Координационные соединения отличаются специфичностью состава, проявляющейся в несовпадении формальной степени окисления атома металла – комплексообразователя и координационного числа и заключающейся в фик- сируемой перестройке электронных оболочек взаимодействующих частиц с об- разованием ковалентной (даже частично ковалентной) связи. Химические связи в координационных соединениях называют координационными, или донорно- акцепторными. Координационные связи могут быть различной химической природы (ионная, ковалентная, полярная; по происхождению – донорно- акцепторная, дативная или иной природы). Кроме того, координационная связь может быть одинарной, двойной и тройной. 3. Координационные соединения отличает время жизни, превышающее время контакта несвязанных частиц и в принципе являющееся постоянной ве- личиной как термодинамических, Система комплексообразователь – лиганды называется внутренней коор- динационной сферой, обычно отделяемой квадратными скобками от внешней координационной сферы Внешнюю координационную сферу составляет определенное количе- ство противоположно заряженных частиц, а иногда и дополнительное количе- ство молекул. К важнейшим параметрам координационных соединений относятся заряд комплекса, координационное число и дентатность лигандов (координаци- онная емкость)
координационная теория: Теория координационных соединений, предложенная А. Вернером в 1893 году, до сих пор является основной теорией координационных соединений (для комплексов определенного вида). Рассмотрим ее основные положения. 1. Большинство элементов проявляет два типа валентности – главную и побочную. 2. Атом элемента стремится насытить не только главные, но и побочные валентности. 3. Побочные валентности атома строго фиксированы в пространстве и определяют геометрию комплекса и его различные свойства. Типы и номенклатура КС 1. Аминокомплексы – комплексы, в которых лигандами служат молекулы аммиака [Cu(NH3)4]SO4, [Co(NH3)6]Cl3. Комплексы, в которых легандами служат молекулы амина (СH3NH2-метиламин, C2H5NH2-этиламин. 2. Аквакомплексы – в которых лигандом выступает H2O. ([Al(H2O)6]Cl3) 3. Ацидокомплексы-в них лигандами явл. анионы, к ним относятся комплексы типа двойных солей K2[PtCl4], K4[Fe(CN)6], PtCl4*2KCl, Fe(CN)2*4KCN; так же комплексные кислоты H2[SiF6]; или гидрокомплексы: Na2[SN(OH)4], Na2CSN(OH)6 4. циклические (Клешневидные). Они содержат леганд, который как бы охватывает центр. ион подобно клешням рака. В зависимости от заряда комплекса КС подразделяют на: катионные - [Cu(NH3)4]Cl2, [Cr(H2O)6]Cl3; анионные - K2[Fe(CN)6], H[AuCl4], H2[SiF6]; катионно-анионные - [Pt(NH3)4][PbCl4] и нейтральные комплексы (неэлектролиты) - [Co(NH3)4(NO3)2], [Pt(NH3)4Br3]. Названия КС с внешней сферой состоят из двух слов (в общем виде “анион катиона”). При этом обязательно указывают в скобках римской цифрой после названия центрального иона его степень окисления. Названия комплексных соединений без внешней сферы состоят из одного слова.
В названиях катионных и нейтральных комплексов комплексообразователи имеют русские наименования соответствующих им элементов. В анионных комплексах используют корни латинских наименований элементов. При этом число одинаковых лигандов указывают греческими числительными: моно-, ди-, три-, тетра-, пента-, гекса- и т.д. Названия отрицательно заряженных лигандов всегда оканчивают на букву “о”: |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 215. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |