
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Закон разбавления Освальда.Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:{\displaystyle \mathrm {K={\frac {c\lambda ^{2}}{\lambda _{\mathcal {1}}(\lambda _{\mathcal {1}}-\lambda )}}} } Здесь {\displaystyle \mathrm {K} }— константа диссоциации электролита, {\displaystyle c}— концентрация,{\displaystyle \lambda } и {\displaystyle \lambda _{1}} — значения эквивалентной электропроводности при концентрации {\displaystyle c} и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства{\displaystyle \mathrm {{\frac {\lambda }{\lambda _{\mathcal {1}}}}=\alpha ,} } где {\displaystyle \alpha } — степень диссоциации. Закон разбавления Оствальда выведен В.Оствальдом в 1888 году и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации. Очень важно понимать, что закон разбавления Оствальда применим только для растворов слабых электролитов, не содержащих посторонних веществ, усиливающих или подавляющих диссоциацию слабого электролита. Ионное произведение воды́ —произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.  Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Водородный показатель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: Водородный показатель имеет важное значение для жизнедеятельности организма, и отклонение его от нормы приводит к расстройству его деятельности. Также рН влияет на урожайность почвы и экологию водоемов. По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10.По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 544. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
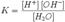
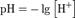 Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может следить критерием силы кислоты или основания.
Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может следить критерием силы кислоты или основания.