
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Теория строения атома Бора- Зоммерфельда.Теория Бора была далее развита А. Зоммерфельдом, который доказал, что при отыскании стационарных состояний должны учитываться не только круговые, но и эллиптические орбиты, а также и и пространственная ориентация, которой орбиты могут приобретать в магнитном поле. Все это привело к введению в теорию новых квантовых чисел. Те же квантовые числа, что и в теории Бора - Зоммерфельда, но в другом толковании достаем при определении стационарных состояний в квантовой механике. Для энергетических уровней ионов расчеты проведены с учетом эллиптичности орбит, как и расчеты, основанные на квантовой механике, дают формулу, которая совпадает по формуле: где n - главное квантовое число, которое определяет размеры орбиты. От этого числа зависит главным образом энергия электрона в атоме. Оно может приобретать только целочисленных значений (n = 1, 2, 3,...). Согласно теории Бора, которая ограничивалась случаем круговых орбит, момент импульса L электрона в атоме определяется только главным квантовым числом: В теории Бора - Зоммерфельда, которая учитывает возможность эллиптических орбит, момент импульса электрона также является величине, кратной h(2π), т.е. элементарному момента импульса, но его значение определяется уже не главным квантовым числом л, а другим квантовым числом l, которое называют орбитальным, побочным, или азимутальной. Квантовая механика. Основные положения квантовой механики: квантование энергии, корпускулярно- волновой характер движения микрочастиц, вероятностный метод описания микрообъектов. Уравнение Шредингера. Квантовые числа (главное, орбительное, магнитное, спиновое): определения, обозначения, значения. Принцип Паули. Правило Хунда. Правило Клечковского. Распределение электронов по квантовым ячейкам S,p,d элементы. Электронные провалы.  Квантовая механика- раздел физики изучающий движение и взаимодействие микрочастиц. В основу положено 3 положения: 1. Положение о квантовой энергии 2. О корпускулярно-волновом строении микрочастиц. 3.вероятностный метод описания микрочастиц. Энергия поглощается, передается или испускается непрерывно, а определяется порциями квантали. Е=h*V(ню) Vчастота, -E- энергия, h-постоянная планка=6.62*10^-34Дж/с. E=h*C/L(лямбда)С=V(ню)*L(лямбда) 2 положение: микрочастица с одной стороны имеют массу как частица, а сдругой обладают длиной волны. L=h/mē*oē УравнениеШредингераd^2 *Ψ/dx^2 +d^2Ψ/dy^2 +d^2Ψ/dz^2 +8∏^2mg/n^2 (E-V)=0 Ψ-волновая функция, Е-полная энергия. Главное квантовое число n определяет основной запас энергии электрона, т.е. степень его удаления от ядра, или размер электронного облака (орбитали). Оно может принимать целочисленные значения от 1 до ∞. Состояние электрона, характеризующееся определенным значением n,называется энергетическим уровнем электрона в атоме. Электроны, имеющие одинаковые значения n, образуют электронные слои (электронные оболочки), обозначаемые цифрами 1,2,3,4,5… или соответственно буквами: K, L, M, N, O… Наименьшее значение энергии Е соответствует n=1. Остальным квантовым состояниям отвечают более высокие значения энергий, и электроны, находящиеся на этих энергетических уровнях, менее прочно связаны с ядром. Орбитальное (побочное или азимутальное) квантовое числоlопределяет орбитальный момент количества движения электрона l = Энергетический подуровень- это состояние электрона в атоме, характеризующееся определенным набором квантовых чисел n, l.Такое состояние электрона, соответствующее определенным значениям n и l (т.е. тип орбитали), записывается в виде сочетания цифрового обозначения n и буквенного l, например:4р (n=4; l=1);5d (n =5; l =2).
Магнитное квантовое число ml определяет значение орбитального момента количества движения электрона L на произвольно выделенную ось z: Lz =  ml, т.е. характеризует пространственную ориентацию электронного облака.
Принцип Паули: В атомной или молекулярной системе не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Правило Хунда: заполнение орбиталей подуровня идет таким образом чтобы сумма спин имело максимальное значение. Правило клечковского: заполнение подуровня электронами идет в порядке увеличения суммы главного и орбитальных квантовых чисел. ∑(n+l) Электронные проавлы характерны для:Cu, Ag,Cr,Au,Nb,Ru,Rh,Pd. Электронные провалы связаны с более устойчивым состоянием полностью замещенного подуровня или наполовину. Связь электронного строения атомов с положением их в Периодической системе. Периодический закон Менделеева и его графическое выражение. Структура периодической системы: периоды, группы. Изменение свойств химических элементов в зависимости от положения в периодической системе. Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов. У каждого последующего элемента периодической системы на один электрон больше, чем у предыдущего. Полные записи электронных конфигураций (формул) первых двух периодов приведены в табл. 1.3. Первый период состоит из двух элементов: водорода и гелия (Z=2). Оба элемента являются s-элементами. Атомом гелия заканчивается формирование первого уровня (K-оболочки; n = 1) атома, обозначим её [He]. У элементов второго периода формируется второй энергетический уровень (L – оболочка; n = 2), заполняются s- и p- подуровни. Li (Z = 3) и Be (Z=4) относятся к s –элементам, остальные шесть элементов периода входят в число p-элементов. У элемента Ne (Z=10) полностью заполнен 2p –подуровень, обозначим его электронную конфигурацию как [Ne]. Электронные конфигурации элементов в основном состоянии в краткой записи представлены в приложении 1(запись электронной конфигурации полностью заполненных подуровней предыдущих периодов не приводится). У элементов 3-го периода заполняется третий уровень (оболочка М; n=3), состоящий из 3s-, 3p- и 3d-орбиталей. Начинается период с натрия (Z=11),электронная конфигурация которого Натрий – аналог лития, аргон – неона. В третьем периоде, так же, как и во втором, восемь элементов, из них два первых элемента Na(Z=11) и Mg(Z=12) являются s-элементами, шесть последних (Al - Ar) – p-элементами. Внешний 4s - электрон придает элементу свойства, сходные со свойствами натрия. Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловливается экранированием(заслонением) ядра плотным и симметричным электронным слоем. После заполнения 3d-орбиталей у последующих шести элементов (Ga-Kr) заполняются p-орбитали внешнего слоя. Четвертый период завершается формированием подуровня 4р у криптона – [Ar] Шестой период содержит 32 элемента (см. приложение 1) и тоже начинается двумя s – элементами ( В седьмом периоде имеются два s – элемента Изложенное показывает, что по мере роста заряда ядра происходит закономерная периодическая повторяемость сходных электронных структур элементов, а следовательно, и повторяемость их свойств, зависящих от строения электронных оболочек атомов. Периодический закон Д. И. Менделеева : Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Периодическая система элементов. Ряды элементов, в пределах которых свойства изменяются последовательно, как, например, ряд из восьми элементов от лития до неона или от натрия до аргона, Менделеев назвал периодами. Если напишем эти два периода один под другим так, чтобы под литием находился натрий, а под неоном — аргон, то получим следующее расположение элементов. При таком расположении в вертикальные столбцы попадают элементы, сходные по своим свойствам и обладающие одинаковой валентностью, например, литий и натрий, бериллий и магний и т. д. Разделив все элементы на периоды и располагая один период под другим так, чтобы Сходные по свойствам и типу образуемых соединений элементы приходились друг под другом, Менделеев составил таблицу, названную им периодической системой элементов по группам и рядам. Период- это совокупность элементов, расположенных в порядке возрастания зарядов их ядер, в атомах которых электроны распределены по одному и тому же числу энергетических уровней. Число уровней, на которых распределяются электроны, равно номеру периода. Поскольку для находящихся в невозбужденном состоянии атомов известных элементов электроны заполняют энергетические уровни от первого до седьмого, периодическая система включает семь периодов. Каждый период содержит определенное число элементов, регламентируемое принципом Паули, который обуславливает конечную емкость энергетических уровней и подуровней, и правилом Клечковского, определяющим порядок заполнения уровней и подуровней электронами. Группа - это совокупность элементов с одинаковым числом валентных электронов, т.е. электронов на орбиталях высшего уровня и на недостроенных внутренних подуровнях. В периодической системе можно выделить семь групп, отвечающих приведенному выше определению, для которых номер группы совпадает с числом валентных электронов; эти группы открываются такими элементами как литий, бериллий, бор, углерод, азот, кислород, фтор. К первой группе по числу валентных электронов следовало бы отнести также водород, однако этот элемент, как уже отмечалось, по физическим и химическим свойствам стоит ближе к галогенам, чем к щелочным металлам. С галогенами водород сближает и то, что для построения структуры благородного газа ему не хватает одного электрона. В силу этого водород относят и I, и к VII группе. Лантаноиды и актиноиды по группам не распределяют, а выносят из системы в виде отдельной двухрядной таблицы. Особое положение в периодической системе занимает VIII группа; для элементов этой группы число валентных электронов может быть равно восьми (благородные газы, начиная с неона, железо, рутений и осмий), но может быть и больше восьми (например, у кобальта и никеля) или меньше восьми (гелий). Таким образом, VIII группа не укладывается в принятое определение группы и является таковой лишь формально. Изменение свойств химических элементов в зависимости от положения в периодической системе. Экспериментальными исследованиями была установлена зависимость химических и физических свойств элементов от их положения в периодической системе. Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы ПС. Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в кристаллах. Радиусы атомов металлов в периодах с ростом порядкового номера элементов уменьшаются, т.к. при одинаковом числе электронных слоев возрастает заряд ядра, а, следовательно, и притяжение им электронов. В пределах каждой группы элементов, как правило, радиусы атомов увеличиваются сверху вниз, т.к. возрастает число энергетических уровней. Радиусы ионов также находятся в периодической зависимости от порядкового номера элемента. По периоду справа налево увеличиваются неметаллические свойства атомов, за счет увеличения заряда ядра атома и трудности отдачи электронов. По подгруппе сверху вниз увеличиваются металлические свойства, т. к. ослабевает связь внешних электронов с ядром.По периоду справа налево увеличивается высшая степень окисления, равная номеру группы, поэтому увеличиваются неметаллические и кислотные свойства. По подгруппе сверху вниз увеличиваются металлические и основные свойства, т.к. увеличивается размер атома и связь с соседним атомом ослабляется. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 804. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 и характеризует форму электронного облака (рис.34.2). Оно принимает все целочисленные значения от 0 до (n-1). Каждому n соответствует определенное число значений орбитального квантового числа, т.е. энергетический уровень представляет собой совокупность энергетических подуровней, несколько различающихся по энергиям. Число подуровней, на которые расщепляется уровень, равно номеру уровня (т.е. численному значению n).
и характеризует форму электронного облака (рис.34.2). Оно принимает все целочисленные значения от 0 до (n-1). Каждому n соответствует определенное число значений орбитального квантового числа, т.е. энергетический уровень представляет собой совокупность энергетических подуровней, несколько различающихся по энергиям. Число подуровней, на которые расщепляется уровень, равно номеру уровня (т.е. численному значению n). , и заканчивается аргоном (Z=18), с электронной конфигурацией
, и заканчивается аргоном (Z=18), с электронной конфигурацией  .
. до
до  относятся к d-элементам. У d - элементов 4-го периода, следовательно, достраивается слой М (третий уровень; n=3) до 18 электронов. В связи с этим важно отметить, что физические и химические свойства элементов в первую очередь определяются структурой внешнего энергетического слоя их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних) электронных слоёв. У атомов всех d-элементов внешний слой образован одним, двумя s-электронами, поэтому химические свойства d-элементов с увеличением порядкового номера изменяются не так резко, как свойства s- и p-элементов. Все d-элементы принадлежат к металлам, тогда как заполнение внешнего p-подуровня приводит к переходу от металла к типичному неметаллу и, наконец, к благородному (инертному) газу.
относятся к d-элементам. У d - элементов 4-го периода, следовательно, достраивается слой М (третий уровень; n=3) до 18 электронов. В связи с этим важно отметить, что физические и химические свойства элементов в первую очередь определяются структурой внешнего энергетического слоя их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних) электронных слоёв. У атомов всех d-элементов внешний слой образован одним, двумя s-электронами, поэтому химические свойства d-элементов с увеличением порядкового номера изменяются не так резко, как свойства s- и p-элементов. Все d-элементы принадлежат к металлам, тогда как заполнение внешнего p-подуровня приводит к переходу от металла к типичному неметаллу и, наконец, к благородному (инертному) газу. или [Kr], являющегося аналогом аргона. Всего в четвертом периоде 18 элементов. Таким образом, четвертый период начинается двумя s-элементами и заканчивается шестью р-элементами, но в отличие от второго и третьего периодов между s- и p-элементами располагаются десять d-элементов (вставная декада большого периода; переходные элементы).
или [Kr], являющегося аналогом аргона. Всего в четвертом периоде 18 элементов. Таким образом, четвертый период начинается двумя s-элементами и заканчивается шестью р-элементами, но в отличие от второго и третьего периодов между s- и p-элементами располагаются десять d-элементов (вставная декада большого периода; переходные элементы).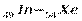 ) заполняется внешний слой. Между s- и р - элементами располагаются десять d – элементов (
) заполняется внешний слой. Между s- и р - элементами располагаются десять d – элементов (  ), у которых заполняются d – орбитали предвнешнего уровня (4d - подуровень). Всего в пятом периоде 18 элементов.
), у которых заполняются d – орбитали предвнешнего уровня (4d - подуровень). Всего в пятом периоде 18 элементов. и
и  ). Далее у лантана начинает заполняться d – орбиталь предвнешнего уровня (5d - подуровень):
). Далее у лантана начинает заполняться d – орбиталь предвнешнего уровня (5d - подуровень): .
. , относящихся к f – элементам. Поскольку у этих элементов заполняется глубинный 4f – подуровень третьего снаружи уровня, они обладают близкими химическими свойствами. С гафния (Z=72) возобновляется заполнение 5d подуровня и заканчивается у ртути (Z=80), после чего электроны заполняют 6р – подуровень: шестой период, как и пятый, завершается шестью р – элементами
, относящихся к f – элементам. Поскольку у этих элементов заполняется глубинный 4f – подуровень третьего снаружи уровня, они обладают близкими химическими свойствами. С гафния (Z=72) возобновляется заполнение 5d подуровня и заканчивается у ртути (Z=80), после чего электроны заполняют 6р – подуровень: шестой период, как и пятый, завершается шестью р – элементами 
 . В шестом периоде 32 элемента, из них: два s – элемента, шесть р – элементов, десять d – элементов и четырнадцать f – элементов.
. В шестом периоде 32 элемента, из них: два s – элемента, шесть р – элементов, десять d – элементов и четырнадцать f – элементов. , за ними следуют d – элемент
, за ними следуют d – элемент 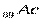 и четырнадцать f – элементов - актиноидов
и четырнадцать f – элементов - актиноидов  , далее снова d – элементы (
, далее снова d – элементы (  , элементы 106 - 110).Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами. В противоположность предыдущим, 7-й период не завершён.
, элементы 106 - 110).Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами. В противоположность предыдущим, 7-й период не завершён.