
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Основы химической кинетики и катализа. Химическое равновесиеСтр 1 из 6Следующая ⇒ Классификация основных классов неорганических веществ. Составление формул и номенклатура химических соединений. Графические формулы химических соединений. Получение химических соединений. Важнейшие свойства химических соединений.особенности взаимодействия химических элементов с кислотами и щелочами. Простое- вещество молекулы которого состоят из атомов одного и того же химического элемента. Сложное-молекулы состоят из атомов различных хим. Элементов Оксид- сложное вещество состоящее из 2х элементов, одним из которых является кислород в степени окисления -2 · Основные оксиды- оксиды металлов, степень окисления которых 1-2 CaO, Na2O,FeO · Кислотные оксиды металлов со степенью окисления 4-6, и оксиды неметаллов (CO2, N2O5,SO3) CO,SiO,Al20- не образуют солей, FeO*FeO3-оксид солеобразующий Гидроксиды- это гидратное (водное) соединение оксида. · Основные (основания)- только гидроксиды металлов со степенью оксиления +1,+2, проявляющие основные свойства ( Ca(OH)2, KOH, NaOH) при реакциях и диссоциации отщепляется группа OH · Кислотные-гидроксиды неметаллов и металлов со степенью окисления +5 +6 проявляющие кислотные свойства( HNO3,H2SO4,H2SO3) · Амфотерные-гидроксиды металлов со степенью окисления +3 +4 и несколько металлов со степенью окисления +2, которые проявляют амфотерные свойства. Оксиды щелочных и некоторых щелочноземельных металлов взаимодействуют с водой образуя щелочи: Na2O+H2O= 2NaOH,нерастворимыеоснования при нагревании как правило разлагаются на оксид и воду: 2Fe(OH)3 =Fe2O3+3H2O, Cu(OH)2=CuO+H2O Щелочи- хорошо растворимые в воде основания. Щелочи как основания взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации). NaOH+HCL=NaCL+ H2O;NaOH+HNO3=NaNO3+H2O.  Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды: Ca(OH)2 +CO2=CaCO3 (осадок)+H2O С амфотерными косидами: 2KOH+ZnO=(темп.)K2ZnO2+H2O С растворами солей щелочь взаимодействует если образуется нерастворимое основание или нерастворимая соль: 2NaOH+CuSO4=Cu(OH)2(осадок)+N; Ba(OH)2+Na2SO4=2NaOH+BaSO4(осадок) Кислоты- элементы которые при диссоциации выделяется ион Н По содержанию атомов кислорода: бескислородные (HCL,H2S) кислородсодержащие (HNO3,H2SO4. По количеству кислых атомов водорода: одноосновные-HNO3 двухосновные-H2SeO4 трехосновные-H3PO4,H3BO3 многоосновные По силе: сильные- диссоциируют практически полностью, константы диссоциации больше 1*10^-3 (HNO3) слабые- константа диссоциации меньше 1*10^-3 (уксусная кислота Кд=1,7*10^-5 По растворимости: растворимые(H2SO4) нерастворимые (H2SiO3) Соли- сложные вещества состоящие из катиона металла и аниона кислотных остатков Средние- продукты замещения всех катионов водорода в молекулах кислоты на катионы металла( полная нейтрализация кислоты и основания) -Na2Co3, K3PO4 Кислые- продукты частичного замещенич катионов водорода в кислотах на катионы металла (неполной нейтрализации кислоты) .NaHCO3, K3PO4 Основные- продукты неполного замещения гидроксoгрупп основания -OH кислотными остатками( неполная нейтрализация основания кислотой). Образуются в условиях избытка основания или недостатка кислоты Комплексные- соли содержащие комплексный ион Na[Zn(OH)4]; [Fe(CO)5] Двойные- соли,состоящие из одного кислотного остатка и катионов нескольких металловCaMg(CO3)2-Доломит (карбонат кальция-магния)K2Ca(SO4)2 *H2O- сингенит ( сульфат кальция калия Смешанные- соли состоящие из нескольких кислотных остатков и одного катиона. Хлорная известь- CaCLCLO-гипохлорид кальция (хлорка) Графические формулы химических соединений Графическая формула- схематичное изображение строения молекул когда химические связи заменяются точками или тире. Правила составления: 1.расставитьстепени окисления у всех элементов молекул. Количество связей=степениокиления. 2. Водород и щелочные металлы соединяются с другими элементами через кислород. 3.за основу берется элемент у которого больше всего связей
Основные понятия и законы химии Атом, химический элемент, молекула, количество вещества, моль. Относительная и абсолютная атомная и молярная масса. Газовые законы, закон Авогадро, уравнение Менделеева-Клайперона. Закон сохранения массы, закон постоянства состава. Эквивалент, молярная масса эквивалента, эквивалентный объем. Определение молярных масс эквивалентов простых и сложных веществ, веществ в реакциях. Закон эквивалентов. Атом-наименьшая часть химического элемента. Состоит из ядра и электронного облака. Ядро состоит из протонов и нейтронов. Химический элемент- совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Молекула- электрически нейтральная частица, образованная из двух и более связанных атомов Количество вещества- физическая величина характеризующая количество однотипных структурных единиц, содержащихся в веществе. Моль- количество вещества которое содержит столько структурных частиц,сколько атомов содержится в 12 г изотопа углерода с массовым числом 12 V(ню)=m/M Относительная атомная масса(Аr)- масса одного атома, выраженная в атомных единицах массы (а.е.м)показывает во сколько раз масса атома больше 1/12 массы атома углерода. 1а.е.м.-величина равная 1/12 массы атома углерода. Абсолютная масса- равная относительной атомной массе, умноженной на 1 а.е.м. Молярная масса- масса вещества количеством 1 моль. Молярная масса численно равна относительной молекулярной массе. Молярная масса- масса 1эквивалента выражено в граммах. Mэ прост.вещества= А/W; Mэ сложного=M/n*W А-атомная масса, W-валентность Mэ реакции=M/число замещ.функци.группMэ (овр)=M/число отд.или присоед. Электронов Мэ слож.в-ва=сумма Мэ(прост.вещества)
Объединенный газовый закон Бойля Мариотта и Гей Люссака: Закон Авогадро-закон, согласно которому в равных объемах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул. Уравнение к.менделееваPV= Закон сохранения массы-масса веществ, вступающих в реакцию, равна массе веществ образ. В результате реакции. Закон постоянства состава- любое химически чистое соединение независимо от способа его получения, состоит из одних и тех же химических элементов, и отношение их масс постоянны. Закон эквивалентовреагирующие друг с другом в количестве пропорциональном их молярным массам эквивалентов. Э-эквивалент (моль) Мэ- Молярная масса эквивалента. m1/Mэ1=m2/Mэ2; m /Mэ= V0/Vэ; w1/Mэ1=w2/Mэ2; x*M1/Mэ1=y*M2/Mэ2 m,m1,m2массы веществMM1 M2молярные массы эквивалентов w1 w2 % содержащегося вещества xyстеометрические коэффициенты V0- объем приведенный к нормальным условиям Vэквивалентный объем Эквивалент (Э)-количество вещества,которое присоединяет , замещяет, высвобождает или каким либо другим образом эквивалентно одному протону в кислотно-основных реакциях (H) или одному электрону в окислительной восстановительных реакциях (e) Э>=1 Эквивалентная концентрация- количество эквивалентов растворенного вещества, содержащегося в одном литре раствора К=m/Mэ
Определения и основные понятия термодинамики, химическая термодинамика (термодинамическая система, фаза,компонент, энергия). Классификация и свойства термодинамических систем.Термохимия. Определения, термохимическое уравнение,экзо- и эндотермические процессы. Законы термохимии( закон Лавуазье-Лапласса, закон Гесса) Характеристические функции состояния термодинамических систем, связь с ихпараметрами систем и друг с другом. Внутренняя энергия. Первый закон термодинамики. Энтальпия, изменение энтальпии, стандартная энтальпия образования.Энтропия, Определения энтропии (вероятностное, энергетическое, техническое и т.д) Энтропия процесса, стандартная энтропия. Второй закон термодинамики. Энергия Гиббса. Стандартная энергия Гиббса образования. Изменение энергии Гиббса. Критерии направления термодинамических процессов, мера необратимости процессов (дельтаS). Критерии принципиальной возможности и невозможности химических процессов (дельта G) Химическая термодинамика-наука, изучающая превращения одних видов энергии и работы в другие. Энергия(Q)-количественная мера движения, выражающаяся способностью материальных объектов совершать работу. Существуют 2 формы передачи энергии: 1.упорядоченная (это работа) 2.неупорядоченная (это теплота) Общая энергияQ-кинетическая энергия V + потенциальная энергияEп + кинетическая энергияEк Термодинамическая система- комплекс взаимодействующих друг с другом хим. Объектов мысленно или реально обособленных от окружающей среды. Фаза- часть системы, обладающая одинаковым химическим составом и одинаковыми параметрами и отделенная от других фаз поверхностью раздела Компоненты- независимые составляющие с помощью которых можно охарактеризовать состав фазы. По характеру взаимодействия с окружающей средой различают системы · изолированные, не обменивающиеся с внешней средой ни энергией, ни веществом; · адиабатически изолированные, не обменивающиеся с внешней средой веществом, но допускающие обмен энергией в виде работы · закрытые, обменивающиеся с внешней средой энергией, но не обменивающиеся веществом; · открытые, обменивающиеся с внешней средой и энергией, и веществом; · частично открытые, обменивающиеся с внешней средой и энергией, и веществом, но у которых не все составляющие вещества принимают участие в материальном обмене (например, из-за наличия полупроницаемых перегородок Закон Лавуазье-Лапласа: теплота образования соединения равна теплоте разложения его, но с обратным знакомΔНºобр= –ΔНºразл. Закон Гесса: тепловой эффект хим. Реакции не зависит от пути перехода системы из начального состояния в конечноеΔНреакц= ΔНст1+ ΔНст2+ ΔНст3+ ΔНст... следствие: стандартный тепловой ффект реакции равенразности сумм стандартных теплот образования продуктов реакции и стандартных теплот образования веществ. ΔHх.р.=сумма ΔHпродуктов-ΔHисходн. А если не стандартный тепловой эффект то уравнение Киргофа: ΔНх.р.=ΔН(тау)+ Внутренняя энергия-энергия поступательно вращательного движения молекул колебательного движения молекул, колебательного движения атомов в молекуле, энергия движения электронов, энергия ядерных сил. Внутр. Энергия то, что внутри системы. Н-энтальпия. Абсолютного значения нет, так что необходимо вычислять ΔН: ΔН=ΔV+pΔV Стандартная энтальпия образования-изменение энтальпии при образовании 1 моля вещества, находящегося в стандартном состоянии, из простыхвеществ, находящихся в стандартном состоянии. Энтальпия реакции
Основы химической кинетики и катализа. Химическое равновесие Актуальность раздела. Предмет химической кинетики. Скорость химической реакции. Факторы влияющие на скорость химической реакции. Влияние концентрации на скорость реакции,. Закон действующих масс для скорости реакйии. Влияние температуры на скорость реакции. Кинетические уравнения. Порядок и молекулярность реакций. Влияние температуры на скорость реакций. Правило Вант Гоффа. Уравнение Аррениуса. Энергия и энтропия активации. Понятие активированного комплекса. Энергетические профили реакций. Влияние катализаторов на скорость реакции. Скорость реакции- изменение концентрации реагирующих веществ в единицу времени в единице объема для гомогенных реакций и на единицу площади поверхности для гетерогенных реакций. V(вектор)=dc/dt=ΔCм/Δt(тау)[моль/литр*с]; V=1/t(тау)[с^-1] Влияние на скорость: 1. Концентрация. 2. Температура 3.катализатор(ингибитор) 4.энергия активации 5.энтропия активации 6. Природа вещества 7.площаль поверхности Влияние концентрации на скорость: закон действующих масс: при постоянной температуре скоростьхимических реакций прямопропорционально произведению концентрации реагирующих или образующих веществ в степенях ихпоказателей по реагентам. Влияние температуры: правило вант гоффа: при изменении температуры на каждые 10 градусов скорость реакции менчется в 2-4 раза V2/V1=Ɣ^T2-T1/10; K2/K1=Ɣ^T2-T1/10; Tтау1/Tтау2=Ɣ^T2-T1/10 Более точно выражается уравнением Аррениуса:k=Aē^Eакт/RT_ *e^ΔS/R; k=Ae^-Eакт/RT. А-предэкспонициальный множитель учитывающий количество столкновений активных молекул, Еакт-избыточная энергия , ΔS-энтропия активации. Энергия активациив химии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Энтропия активации рассматривается как разность энтропии переходного состояния и основного состояния реагентов. Она определяется главным образом потерей трансляционной и вращательной степеней свободы частиц при образовании активированного комплекса. Существенные изменения (колебательной степени свободы могут также произойти, если активированный комплекс несколько более плотно упакован, чем реагенты. Если энергия активации меньше 100 кДж/моль, то такая реакция ротекает с маленькой скоростью. Если меньше 50 кДж/моль то реакция протекает с большой скоростью.
Химическое равновесие. Термодинамический и кинетический признаки химического равновесия. Константа химического равновесия(закон действующих масс для химического равновесия).Величина константы равновесия в зависимости от ее размерности и способа изерения концентрации. Связь Кс с Кр и Kf. Принцип Ле-шателье. Факторы, влияющие на смещение химического равновесия. Связьэнергии Гиббса с константой химического равновесия. Химическое равновесие- состояние когда скорость прямой реакции равна скорости обратной V→=V←, ΔG=0, , ΔH=T, ΔS. Химическое равновесие характеризуется константой равновесия. Закон действующих масс для химического равновесия: при постоянной температуре отношениеп произведения равновесных молярных концентраций продуктов реакции в степенях их стехиометрических коэффициентов к произведению равновесно молярных концентраций их веществ в степенях их стех.коэф. Кс=[HI]^2/[H2][I2]- пример здм для хим.реакции. моль/л Кс зависит от температуры, природы реагирующего вещества, ине зависит от концентрации и катализатора Кр=P^2 (HI)/P(H2)*P(I2). Р-парциальное давление, которое оказывает вещество в смеси. Кр=Кс(RT)^Δn. , Δп-разница количества молей продуктов и исходных веществ. Здм учитывает только газы и жидкости, твердые вещества не учитываются. ΔGх.р=-2.303 RTlgKcΔGх.р.<0, если lgКс>0. Кс>1 реакция идет; ΔGх.р. >0 lgKc<0, Kc<1 Принцип Ле-шателье: если на систему наход. В равновесии оказывает какое-либо воздействие, то в ней возникают силы противодействия. 1) влияние на хим. Равновесие а)при увеличении температуры хим.равновесие смещается в сторону эндотермического процесса б) при уменьшении температуры в сторону экзотермического процесса. ΔНх.р.=∑ ΔHпродукта-∑ΔНисходных. ΔН хр=-Q;Q=m*Cp*Δt (Ср-теплоемкость табличное значение.) 2) влияние давления А) при увеличении давления хим.равновесии смещается в сторону меньшего числа молей газов. Б) при уменьшении давления хим.равновесие смещается в сторону большего числа молей газов. Если число молей равно, то давление не влияет. 3) влияние объема обратно давлению 4) влияние концентрации смотрится по константе равновесия Стандартное изменение энергии Гиббса для реакции А+В→АВ равно начальной концентрации А и В по 1 моль на литр. Найти константу равновесия. К с=0.04. как найти равновесие: Кс=[AB]/[A][B]; [A]=[A]0-[AB]
Планетарная модель строения атома. Строение атома (ядро,электрон, протон нейтрон, нуклоны). Изотопы, изотоны, изобары. Строение ядер. Противоречия планетарной модели строения атома. Постулаты Бора. Теория строения Бора-Зоммерфельда. Планета́рная моде́ль а́тома, или модель атома Резерфо́рда, — исторически важная модель строения атома, предложенная Эрнстом Резерфордом в классической статье[1], опубликованной в 1911 г. на основании анализа и статистической обработки результатов экспериментов по рассеиванию альфа-частиц в тонкой золотой фольге, выполненных Гейгером и Марсденом в 1909 г.В этой модели Резерфорд описывает строение атома состоящим из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны, — подобно тому, как планеты движутся вокруг Солнца. Ядро атома состоит из нуклонов: протонов и нейтронов. Общее число нуклонов в ядре называют массовымчислом А. Число протонов в ядре равно порядковому номеру в системе элементов Менделеева Z (числу протонов в ядре или числу электронов в атоме), число нейтронов Ядро обозначают символом. Ядра могут иметь несколько изотопов, характеризующимися одним и тем же порядковым номером Z, но различными А и N. Например, – ядро водорода – протон; – ядро дейтерия – дейтрон (d); – ядро трития – тритон (t). Электрический заряд ядра равен числу положительно заряженных протонов в ядре. Размеры ядер зависят от числа нуклонов в ядре, и как у всякой квантовой системы у атомного ядра нет четко выраженной границы. Протон - элементарная частица в составе атомного ядра массой 1,67-10~24 г, имеющая положительный заряд 1,6-10"19 Кл. Протон был открыт в 1920 г. английским физиком Э. Резерфордом. Нейтрон - элементарная частица в составе атомного ядра массой 1,67 •10~24 г. Не заряжена. Нейтрон был открыт в 1932 г. английским физиком Дж. Чедвиком. Сумму протонов и нейтронов называют нуклонами. В состав ядра, кроме протонов и нейтронов, входит множество других микрочастиц, ЭЛЕКТРО́НЭлементарная частица с наименьшим отрицательным электрическим зарядом. Нукло́ны — общее название для протонов и нейтронов. С точки зрения электромагнитного взаимодействия протон и нейтрон — разные частицы, так как протон электрически заряжен, а нейтрон — нет. Изотопы- разновидности атомов, имеющих одинаковые заряды ядер, но разные атомные массы (за счет разного числа нейтронов в ядре), например, Mg и Mg, С1и С1. 94 9S "3S37 Самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер (ос-частицы), называется радиоактивностью. Изобары - это атомы, имеющие одинаковые массовые числа, но различные заряды ядер и разные химические свойства. Например, атомы аргона, калия и кальция - 40Аг, 40К, 40Са. Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Противоречи планетарной модели строения атома. Постулаты Бора Основным недостатком планетарной модели строения атома Резерфорда было ее противоречие теории классической электродинамики, которая утверждает, что, двигаясь по круговой орбите, электрон как заряженная частица должен непрерывно излучать энергию и "достаточно быстро упасть на ядро". Нильс Бор пришел к выводу, что микрочастицы отличаются по свойствам от макрообъектов, поэтому классической электродинамики недостаточно для их описания. В своей теории Бор использовал представления классической механики о движении заряженной частицы в электрическом поле, дополнив их идеями квантования энергии. При этом он выдвинул три постулата (постулат – утверждение в теории, принимаемое за истинное, хотя и недоказуемое в рамках этой теории). Первый постулат. Электроны в атоме могут двигаться только по некоторым определенным устойчивым стационарным круговым орбитам. При движении по этим орбитам электроны не излучают энергию, то есть существует ряд стационарных состояний атома, соответствующих определенным значениям его энергии. Второй постулат.При переходе электрон с одной стационарной орбиты на другую атом испускает или поглощает квант электромагнитного излучения, энергия которого (hn) равна разности энергий стационарных состояний:hn=E1–E2, где h – постоянна планка, n – частота излучения. Третий постулат. В атоме существуют только такие электронные орбиты, находясь на которых электрон обладает моментом количества движения, кратным M = m×v×r = где M – момент количества движения электрона; m = 9,11×10-31 кг – масса электрона; v – скорость электрона; r – радиус орбиты электрона; h = 6,63×10-34Дж×с – постоянная Планка; n = 1,2,3 ... – целое число, получившее название «квантовое число». Используя эти постулаты, Бор рассчитал размеры стационарных орбит электронов в атоме, энергию электронов на стационарных орбитах и выразил постоянную Ридберга через основные константы. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 444. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
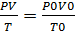 Р0,V0,T0-давление,объем газа и температура принормальных условиях (Р=101,3кПа, Т=273К, объем=22.4л)
Р0,V0,T0-давление,объем газа и температура принормальных условиях (Р=101,3кПа, Т=273К, объем=22.4л)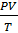
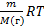 ; m=PVM/PV; M()=mRT /PV
; m=PVM/PV; M()=mRT /PV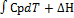
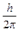 (часто вводят обозначение
(часто вводят обозначение 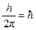 ):
):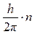 ,
,