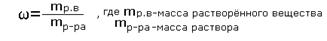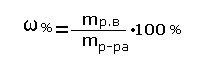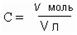Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Металлическая связь. Водородная связь. Межмолекулярное взаимодействие. Описание химической связи по методу молекулярных орбиталейМеталлическая связь- возникает в металле за счёт взаимодействия небольшого количеств электронов свободно перемещающихся по металлу и большого количества атомных ядер. Металлическая связь сильно d-локализована. Для описания металлической связи используется зонная теория металлов. Водородная связь- это связь образованная между атомом водорода и сильно электроотрицательными элементами. Межмолекулярное взаимодействие( или сила Ван дер Ваальса)- взаимодействие без передачи атомов электронов. Складывается из ориентационной составляющей, индукционной и дисперсной Метод молекулярных орбиталей: в методе мо молекулы рассматриваются как единое целое и электроны расположен в поле действия всех ядер. Различают молекулярные орбитали6 сигма. Пи, дельта. В методе МО атомные орбитали подвергаются линейной комбинации (сложению и вычитанию). Из n количества атомов орбиталей- получается n. Распределение электронов подчиняются принципу Паули и правилу Хонда. В методе МО в образовании связи может принимать участие 1 электрон. Отличие атомных от молекулярных орбиталей состоит в том, что первые-одноцентровые, а вторые- много центровые. Различают МО: связующие, разрыхляющие и несвязующие. Бетта 25^d пи2рх^св –связующие. Бетта25^разПи 2ру^раз –разрыхляющие Если теряя молекулы орбиталь уменьшется не образ. Связующая, если увеличивается-то разрыхляющая. При заполнении МО сначала заполняется связующая, а потом разрыхляющая. Система Т-Ж:классификация. Растворы с жидкой дисперсионной средой. Природа растворов. Коллигативные свойства растворов. Законы Генри и Рауля. Осмотическое давление. Закон Вант-Гоффа. Качественные и количественные характеристики растворов.  Классификация по агрегатному состоянию. Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среди и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы "газ в жидкости" принято обозначение Г/Ж
Суспензии — дисперсные системы, в которых дисперсной фазой является твердое вещество, а дисперсионной средой — жидкость, — причем твердое вещество практически нерастворимо в жидкости. Чтобы приготовить суспензию, надо вещество измельчить до тонкого порошка, высыпать в жидкость, в которой вещество не растворяется, и хорошо взболтать (например, взбалтывание глины в воде). Со временем частички выпадут на дно сосуда. Этот процесс называется седиментацией. Очевидно, чем меньше частички, тем дольше будет сохраняться суспензия. Поэтому седиментационная неустойчивость тем выше, чем крупнее частицы. Эмульсии — дисперсные системы, в которых и дисперсная фаза и дисперсионная среда являются жидкостями, взаимно не смешивающихся. Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Примером эмульсии является молоко, в котором мелкие шарики жира плавают в жидкости. Суспензии и эмульсии — двухфазные системы. Пены. Как и эмульсии, пены — грубодисперсные системы, Поэтому во многих технологических процессах пены получают теми же диспергационными методами, которые применяют для получения газовых пузырьков. Аэрозоль – дисперсная система, состоящая из мелких, твёрдых или жидких частиц, взвешенных в газовой среде. Аэрозоли, дисперсная фаза которых состоит из капелек жидкости, называются туманами, а в случае твёрдой дисперсной фазы – дымами. Пыль относят к грубодисперсным аэрозолям. раствор - это сложная, термодинамически устойчивая химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия. Основными компонентами раствора являются растворитель (дисперсионная среда) и растворенное вещество (дисперсная фаза). Это деление чисто условно. Если раствор образуется при смешивании компонентов одинакового агрегатного состояния, то растворителем считается компонент, которого в растворе больше. В остальных случаях растворителем обычно является жидкость или компонент агрегатное состояние которого не меняется при образовании раствора. Коллигативными (общими)свойствами раствора являются те свойства, которые зависят от природы растворителя и концентрации растворенного вещества, но не зависят от свойств самого растворенного вещества. К ним относятся: Относительное понижение давления насыщенного пара растворителя над раствором. Увеличение температуры кипения раствора по сравнению с чистым растворителем. Уменьшение температуры замерзания раствора по сравнению с чистым растворителем. Осмотическое давление. раствор - это сложная, термодинамически устойчивая химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия. Закон Генри- растворимость газов постоянной температуре пропорциональна давлению. См=P/RT-для не электролитов. Если будет электролит¸то: См=P/RT *Ii-изотон.коэффициент (учитывает степень диссоциации) ; L(альфа)=i-1/n-1 L-степень диссоциации Законы Рауля: 1й. относительное понижение давления пара растворителя над раствором пропорционально мольной доле растворенного вещества. P0-P/P0=nдавление водяных паров- табличное значение. 2й. понижение температуры замерзания или повышение температуры кипения пропорционально моляльной концентрации раствора 1. Δtзамер=Кфиоскип.*См=mчис.в-ва *1000*Kкри./M*mрастворителя; 2. Δtкип=К эбулиоскопическая *См=mч.в-ва*1000*Kэбул./M*m растворителя. К криоск. И К эбул. Не зависит от природы вещества,а зависит от природы расворителя. Это табличная величина.
А если электролит, то: 1 *i 2*i Tкип=100+Δt кип. Для воды Tзамерз.=0-Δtзамерз. Для воды Осмос-односторонняя диффузия через полупронецаемую перегородку. Условия: раствор, растворитель и полупроницаемая перегородка. Pосм=pgh (g=9.81 м/с^2) Закон Вант-Гоффа: осмотическое давление разбавляемых растворов пропорционально молярной концентрации и температуре. Pосм= СмRT; если электролит, то: Росм=СмRT*i Для качественной характеристики растворов используют понятия «разбавленный раствор» (содержит мало растворенного вещества) и «концентрированный раствор» (содержит много растворенного вещества). При работе с растворами необходимо знать их количественный состав. Количественный состав растворов выражается различными способами. Мы изучим два способа: а) массовая доля растворенного вещества; б) молярная концентрация (молярность). Массовая доля растворённого вещества -это отношение массы растворённого вещества к массе раствора.
Для расчёта процентной концентрации используется формула:
Массовая доля растворённого вещества wрастворённого вещества- это безразмерная величина, равная отношению массы растворённого вещества mрастворённого вещества к общей массе раствора mраствора : mраствора = mрастворённого вещества + mрастворителя Массовую долю растворённого вещества(процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Молярная концентрация С – это отношение количества растворенного вещества v (в молях) к объему раствора V в литрах.
Молярную концентрацию (или МОЛЯРНОСТЬ растворов) принято обозначать буквой М.Например, раствор концентрации 1 М содержит 1 моль вещества на литр раствора. Такой раствор называют МОЛЯРНЫМ.
Электролиты и неэлектролиты. Классификация электролитов. Тория электролитической диссоциации. Диссоциация электролитов. Количественные характеристики электролитической диссоциации: степень диссоциации и константа диссоциации. Закон разбавления Оствальда. Ионное произведение воды. Водородный и гидроксильный показатели. Индикаторы. Вода: особенности строения и свойств. Активированная вода. Электролитами называются вещества (исключая металлы), растворы или расплавы которых проводят электрический ток. К электролитам относятся соединения, образованные ионными или ковалентными полярными связями. Это сложные вещества: соли, основания, кислоты, оксиды металлов (проводят электрический ток только в расплавах). Неэлектролитаминазываются вещества, растворы или расплавы которых электрический ток не проводят. К ним относятся простые и сложные вещества, образованные малополярными или неполярными ковалентными связями. Свойства растворов и расплавов электролитов впервые объяснил в конце XIXвека шведский учёный Сванте Аррениус. Им была создана специальнаятеория электролитической диссоциации, основные положения которой, доработанные и развитые другими учёными, в настоящее время формулируются следующим образом. 1. Молекулы (или формульные единицы) электролитов в растворах или расплавах распадаются на положительно и отрицательно заряженные ионы. Этот процесс называется электролитической диссоциацией. Общая сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов, поэтому растворы или расплавы электролитов в целом остаются электронейтральными.Ионы могут быть какпростые, состоящие только из одного атома (Na+,Cu2+,Cl–,S2-), так исложные, состоящие из атомов нескольких элементов (SO42–,PO43–,NH4+, [Al(OH)4]–). Распад электролитов на ионы в расплавах осуществляется за счёт действия высоких температур, а в растворах за счёт действия молекул растворителя. Особенностью ионных соединений является то, что в узлах их кристаллической решётки имеются уже готовые ионы и в процессе таких веществ растворения диполям растворителя (воды) остаётся только разрушить эту ионную решётку Процесс электролитической диссоциации протекает одновременно с процессом растворения веществ, и поэтому в растворах все ионы находятся в гидратированном состоянии (окружены оболочками из молекул Н2О). 2. Ионы электролитов в растворе или расплаве за счёт теплового движения хаотически перемещаются по всем направлениям. Но если в раствор или расплав опустить электроды и пропустить электрический ток, то положительно заряженные ионы электролита начинают двигаться к отрицательно заряженному электроду – катоду (поэтому они иначе называются катионами), а отрицательно заряженные ионы – к положительно заряженному электроду – аноду (поэтому они иначе называются анионами). Таким образом, электролиты являются проводниками второго рода. Они переносят электрический заряд за счёт направленного движения ионов. Металлы же являются проводниками первого рода, т.к. проводят электрический ток за счёт направленного движения электронов. 3. Процесс электролитической диссоциации обратим. Наряду с распадом молекул на ионы всегда протекает обратный процесс – соединение ионов в молекулы или ассоциация. Поэтому в уравнениях реакций электролитической диссоциации веществ вместо знака равенства «=» ставят знак обратимости Степенью диссоциации называется отношение количества электролита, распавшегося на ионы (n), к общему количеству электролита (n0) В зависимости от величины степени диссоциации различают слабые и сильные электролиты. К слабымэлектролитам относят вещества, у которых степень диссоциации в 0,1 М растворах меньше 3%; если степень диссоциации в 0,1 М растворе превышает 30%, то такой электролит называют сильным. Электролиты, степень диссоциации которых лежит в пределах от 3% до 30%, называются электролитами средней силы. Диссоциации. Степенью диссоциации α называют –отношение числа молекул, распавшихся на ионы (n) к общему числу растворенных молекул (n0).α = (n/n0)∙100 Процесс электролитической диссоциации характеризуют константой диссоциации(К). Так, для реакции КА К+ + А– константа диссоциации: К = [К+]∙[ А–]/[КА] Между константой и степенью электролитической диссоциации существует количественная связь. В приведенном примере общую концентрацию растворенного вещества обозначим с, а степень диссоциации α. Тогда [К+] = [А–] = α∙с и соответственно концентрация недиссоциированных частиц [КА] = (1 – α)с. |
||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 381. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |