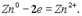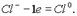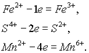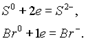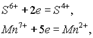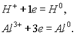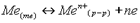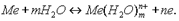Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Окислители и восстановителиОкисление — это проц отдачи электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд:
Если отрицательно заряженный ион (заряд -1), например Сl- , отдает 1 электрон, то он становится нейтральным атомом: Если полож заряженный ион или атом отдает электроны, то величина его положит заряда увеличив соответственно числу отданных электронов:
Восстановление — это проц присоединения электронов атомом, молекулой или ионом.Если атом присоединяет электроны, то он превращ в отрицательно заряженный ион:
Если полож заряж ион принимает электроны, то велич его заряда уменьш:
или он может перейти в нейтрал атом:
Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны. Типы окислит-восстанов реакций Окисл-восстанреакции можно разделить на три типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования (самоокисления - самовосстановления). Межмолекулярными наз окисл-восстан реакции, в рез кот изменстепень окисления атомов в разных веществах. Так обр, в роли окислителя и восстановителя в этом случае выступают разные вещества. Например:2Ca + O2 = 2CaOТакие окисл-восстано реакции встречаются чаще всего. Внутримолекулярными наз окисл-восстан реак, в результате котменяется степень окисления разных атомов в одном и том же в-ве. В этом случае в роли окислителя и восстановителя выст разные атомы в одном и том же соединении. Например:2KClO3 = 2KCl + 3O2 Здесь хлор восстанавливается, а кислород окисляется. Реакциями диспропорционирования (дисмутации) наз окисл-восстан реакции, в ходе кот одновременно понижается и повыш степень окисления одного и того же элемента. В таких реакциях в роли окисл-ля и восст-ля выступают атомы одного и того же элемента. Например:4KClO3 = KCl + 3KClO4  Реакции диспропорционирования возможны, когда в исходном в-ве элемент имеет промежуточную степень окисления. Обратные реакции, в результате которых из двух степеней окисления одного элемента образ новая степень окисления, промежуточная между исходными, называются реакциями конпропорционирования (конмутации). Вместо термиров «диспропорционирование» и «конпропорционирование» употребляют также термин «самоокисление-самовосстановление». Окислит-восстан потенциалы Окисл-восстановпотенциалы определяют возможность и направленность протекания окисл-восстан реакций. 1. Пластинка активного металла Поскольку металл активен, катионы из пластинки переходят в раствор. Чем активнее металл, тем разность потенциалов выше. Активный малоактивный
Е<0 Е>0. Представим себе металлич пластинку, погруженную в воду. Под действием полярных молекул воды ионы металла отрываются от поверх пластинки и гидратированными переходят в жидкую фазу. Последняя при этом заряжается полож, а на металлической пластинке появляется избыток электронов. Чем дальше протекает процесс, тем больше становится заряд, как пластинки, так и жидкой фазы. Наконец, наступает момент, когда между раствором и металлич пластинкой устанавл равновесие, которое можно выраз уравн:
или с учетом гидратации ионов в растворе:
При погружении металла в раствор на границе раздела фаз образ двойной электрический слой. Разность потенциалов, возник между металлом и окружего жидкой фазой, наз электродным потенциалом.Этот потенциал явл характерист окисл-восстан способности металла в виде твердой фазы.У изолированного металлич атома (состояние одноатомного пара, возникающее при выс темпер и высоких степенях разрежения) окислит-восстан с-ва характериздругой величиной, назионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома. Стандартный водородный электрод состоит из специально приготовленной платиновой пластинки, погруженной в раствор кислоты с концентрацией ионов водорода 1 моль/л и омываемой струёй газообразного водорода под давлением 105 Па, при температуре 25 °С.Ряд напряжений характеризует хим свойства металлов:1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, кот стоят в электрохимическом ряду напряжений металлов после него.3. Все металлы, имеющие отриц стандартный электродный потенциал, т. е. находящиеся в электрохимическом ряду напряжметаллов левее водорода, способны вытеснять его из растворов кислот. Алгебраич значение стандартного окисл-восстан потенциала характеризует окислительную активнсоответствующей окисленной формы. Поэтому сопоставление значений стандартных окисл-восстан потенциалов позволяет ответить на вопрос: протекает ли та или иная окислительно-восстановительная реакция? Количественным критерием оценки возможности протекания той или иной окисл-восстан реакции является полож значение разности стандартных окисл-восстанх потенциалов полуреакций окисления и восстановления. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 385. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |