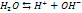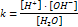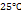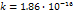Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Растворимость веществ в воде.Стр 1 из 29Следующая ⇒ Хим состав и строение молек воды. В 1783 году был открыт состав воды физиком Лавуазье.(Н2О);1805г. – открыто строение воды. Электронные облака молекул воды распол в форме неправил тетраэдра. Атом кислорода оказыва при этом в центре, а два атома водорода – в противоположных углах одной из граней куба. Угол между ними составляет 1040 31¢. Два из восьми электронов расп около ядра, два др связаны с атомами водорода, а две неподеленные пары электронов образ ветви, расп в противоположном направл по отн к электронным облакам водородов.Вода – 2Н 16О;Изотопы воды –2Н 17О (0,04% в природе); 3Н 18О(0,2% в природе).Если электроны движ в одном направлении – это пара-вода. Если электроны движ в разных направл – это орто-вода.Если бы молекулы воды не имели отрицат заряженных ветвей электронного облака и дипольных моментов, они не могли бы взаимодействовать друг с другом. Водородные взаимодействия. Водор связи – связи, которые образ между полож заряженными атомами водорода одной молекулы и отриц заряж атомами другой молекулы. (кислород, азот, фтор, фосфор). Возникн водородной связи объясняется св-вом атома водорода взаимод с сильно электроотрицательным элементом(с кислородом др молек воды). Такая особенн водородн атома обусловл тем, что, отдавая свой единственный электрон на образов ковалентной связи с кислородом, он остается в виде ядра очень малого размера, почти лишенного электронной оболочки. Поэтому он не испыт отталкивания от электронной оболочки кислорода другой молекулы воды, а, наоборот, притягивается ею и может вступить с нею во взаимод. Наиб устойчивость у удвоенных молекул (Н2О)2, образование кот сопровождается возникн 2-х водородных связей. Согласно методу электронных орбиталей водородная связь образ за счет дисперсионных сил, ковалентной связи и электростатического взаимод.  Агрегатные состояния воды. 1.Жидкая вода: – в воде сущ элем упорядоченности, между кот расположены отдельные молек воды;– хаотичное распол молекул 2.Лед(00 С) – кристаллическая стр-ра, нет упорядоченного строения. При образ кристаллич стр-ры между молекулами воды образ пустоты с размером больше молекулы воды. Плотность льда ниже плотности воды, вода при замерзании расширяется.Модификации льда(14шт.):– Если вода замерзает при повыш давлении, образ лед повышенной плотности, плотнее жидкой воды.– При t=–1200C вода становится сверх вязкой и тягучей как вата.– При охлаждении до -1300С вода теряет кристаллич стр-ру и стан аморфной, превращ в стекловидную массу.– абсолютно чистая вода при t=-380C. Ниже этой темпер вода кристаллизуется. Горячая вода замерзает быстрее холодно – эффект Мкемба. 3. Газообр сост. Для перевода воды из жидкого в газообр сост необходимо преодолеть силы межмолекул взаимод. Работа испарения – работа по преодолению межмолекул взаимод, характериз теплотой испарения. У воды по сравнению с другими жидкостями максим теплота испарения и максим теплота плавления. Аномалии воды.Известно 66 аномалий воды.Нек из них:– Аномально выс t плавления и кип по сравн с вещ анал-ого строения.– Увелич объема и уменьшение плотности при замерзании.–Огромное поверхн натяжение воды.– Аномально выс теплота исп и плавления.– Легче всего вода нагрев и быстрее всего охлаждается в так наз «температурной яме» (370С).–Ни одна жидкость не поглощает газы с такой жадностью как вода, также она легко отдает газы.–После магнитной обработки воды увелич растворимость солей в воде, увелич скорость протекания реакций. При кипяч воды, обраб магнитом, не образуется накипь, а также срывается со стенок уже им накипь.–Память воды. Химические свойства воды. 1. Разложение 2. Универсальный растворитель – за счет полярного соединения; 3. Катализатор во многих процессах(сухой бензин не горит); Сущ 4 типа важн химич реакций, в кот участвует вода.1 тип: Кислотно-основная реакция.
2 тип: Окислит-восстан реакции. С водой реагируют все металлы до алюминия включительно.
При коррозии:
3 тип: Гидратация – способность воды сольватировать как катионы, так и анионы.Кристаллизационн вода – гидратированная вода, содержащаяся в кристаллах солей.
4 тип:Гидролиз(реакция обмена веществ с водой).
Вода способн образов клотраты.
Свойства растворов 6. Физико-химич св-ва растворов неэлектролитов и электролитов. Первый закон Рауля: в разбавленных р-рах неэлектролитов при пост t относительное понижение давления насыщ пара раств-ля над раствором равно мольной доле растворённого вещества в растворе:
где Р0 – давл над чистым растворителем, Р – давл растворителя над раствором, n – химич количество растворённого вещества, N – химическое количество растворителя Второй закон Рауля: увелич t кипения (Тк) и умен t замерзания (Тз) тем болmше, чем больше конц-ия растворённого в-ва:
где Е – эбуллиоскопическая пост, Ст – молярная концентрация где К – криоскопическая постоянная
Уравнение Вант-Гоффа:
где Росм – осмотич давл (кПа), С – молярная концентр раст-ра (моль/л), R – универсальная газовая постоянная (8,31), Т – температура (К) Уравнен, характериз общие св-ва ра-ров неэлектролитов, можно использ для растворов электролитов, если ввести в них поправочный коэфф.
где i – изотонический коэфф
где
Св-ва раст-ов слаб электролитов. Закон разбавлен Оствальда:
Если Диссоциация слабых кислот:
Всегда Диссоциация слабых оснований:
Ионные равновесия Растворимость веществ в воде. Мера растворимости – способн вещ-ва растворяться в воде при данных услов с образ насыщ р-ра. Насыщенный р-р – р-р, наход в равновесии с растворенным веществом при дан усл, содержащий макс кол-во растворенного в-ва. Концентрированный р-р – р-р, в кот находится более 20% растворенного в-ва. Р-р может быть концентрированным, но не насыщенным. Растворимость зависит от: Природы растворяемого в-ва и растворителя Правила: подобное растворяется в подобном; полярные в-ва раствоh в полярных растворителях, а неполярные – в неполярных растворителях. Если молекула газа способна образовывать хим связи с водой, то растворимость этого газа высока:
Агрегатное состояние и наличие посторонних в-в Посторонние вещества умен растворимость в-в в воде - высаливание.
Температура Растворимость газа при выс t умен. Растворимость тв в-в зависит от теплового эффекта растворителя: если теплота выделяется при повыш t, то растворимость уменьш; если поглощается при повыш t, растворимость увеличивается. Влияние давления С увелич давления растворимость увелич. Если над р-ром сод смесь газов, то их растворимость прямопропорциональна парциальному давл каждого газа. Закон Генри-Дальтона:
где Произведение растворимости Произв растворимости – количественный показатель степени нерастворимости солей и гидроксидов.
Если произведение концентрации ионов (ПК) будет меньше ПР, то раствор ненасыщенный и осадка нет. Если ПК больше ПР, то выпадает осадок и раствор перенасыщен. Если то раствор насыщен. Диссоциация воды. Вода является слабым электролитом. Диссоц воды - разлож воды на составляющие хим элементы, иногда происходящая с созд новых элементов, изначально в разлагаемом р-ре не содержащихся, или содержащихся до начала разлож в меньшем колич, чем после завершения проц диссоциации. Диссоциация воды явл эндотермической реакцией, т.е. идущей с поглощением теплоты из окруж среды.
При Ионное произведение воды Кw [Н2О] = [Н+] [ОН-] = 10-14 при 25°С – ионное произведение воды рН= -lg [H+] рОН= -lg [ОH-] рОН= 14 – рН [H+] = [ОH-], то рН=7 – среда нейтральная [H+] > [ОH-], то рН<7 – кислая среда |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 414. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
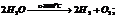
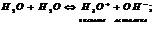
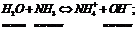
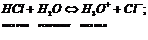
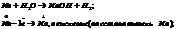
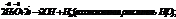
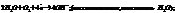 Вода как восст-ль ведет себя в биохимич процессах(фотосинтез):
Вода как восст-ль ведет себя в биохимич процессах(фотосинтез):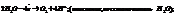
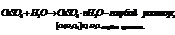
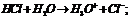
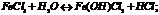
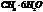 – неустойчивы,при повышении температуры разлагаются.
– неустойчивы,при повышении температуры разлагаются.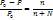
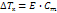
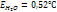
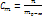
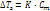
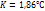
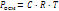
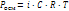
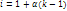
 – степ диссоциации, k – кол-во ионов, образ-хся при диссоциации
– степ диссоциации, k – кол-во ионов, образ-хся при диссоциации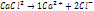
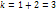
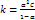 – для слабых электролитов
– для слабых электролитов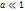 , то
, то 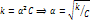 – для разбавл растворов. Коэффиц диссоциации
– для разбавл растворов. Коэффиц диссоциации 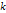 зависит от природы растворителя и вещ-ва, а также от t (чем больше t, тем больше коэффициент диссоциации).Для сильных электролитов
зависит от природы растворителя и вещ-ва, а также от t (чем больше t, тем больше коэффициент диссоциации).Для сильных электролитов 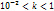
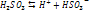 - I стадия
- I стадия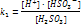
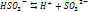 - II стадия
- II стадия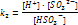
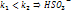 прочнее чем
прочнее чем 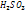
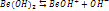 - I стадия
- I стадия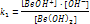
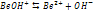 - II стадия
- II стадия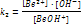
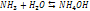
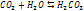
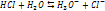
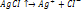
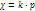
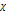 – молярная доза вещества в насыще р-ре, k – постоянная Генри, p – порциальное давление газов.
– молярная доза вещества в насыще р-ре, k – постоянная Генри, p – порциальное давление газов.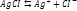
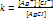
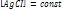
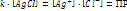
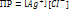 – постоянная при данной температуре
– постоянная при данной температуре