Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
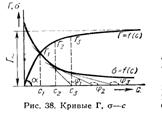
РАЗРУШЕНИЕ ДИСПЕРСНЫХ СИСТЕМДля колл систем введены понятия о кинетич и агрегативной устойчивости. Под кинетич устойчивостью понимают способн частиц колло р-ра находиться во взвешенном состоянии даже при существенном различии в плотностях дисперсионной среды и дисперсной фазы. Кинетич устойчивость свойственна сильно разбавленным р-рам и очень высокодисперсным золям. Агрегативная устойчивость — способность системы сохранять свою степень дисперсности. Устойчивость коллоидных растворов связана с наличием одноименного заряда у коллоидных частиц. Двигаясь, частицы сближаются, при этом проявляются действие отталкивания одноименных ядер частиц и действие притяжения за счет межмолекулярных сил. В зависимости от того, какие силы преобладают, система либо устойчива, либо частицы дисперсной фазы слипаются и укрупняются. Устойчивость колл ров можно повысить введением стабилизаторов. В качестве стабилизаторов исп высокомолекул соединения, такие, как белки, поверхностно-активные вещества и т.д. Стабилизаторы адсорбируются в поверхностном слое частиц и как бы придают золю свойства р-ра использованного стабилизатора. Под возд разл факторов коллоидные растворы способны разрушаться. Разрушение может сопровождаться слипанием отдельных частиц с образованием крупных агрегатов. Такой процесс разрушения коллоидного р-ра называется коагуляцией. Коагуляция нарушает агрегативную устойчивость колл р-ра, крупные агрегаты частиц легко седиментируют под действием гравитационных сил.Причиной коагуляции могут быть самые разнообразные факторы: изменение температуры и конц-ции коллоидного р-ра, его старение, механич воздействия, введение в раствор золей с противоположным знаком заряда, добавление электролитов. Наиб практическое значение имеет последний фактор.  При введении в золь электролита (коагулянта) коагулирующее действие оказывает ион, им противоположный заряд: для отрицат заряженных золей — катион, для золей с положит зарядом частицы — анион. Наименьшая концентрация электролита, вызывающая коагуляцию, назпорогом коагуляции. Чем выше заряд коагулирующего иона, тем ниже его пороговая концентрация. Коагуляция золя происх при достижении в растворе критической величины ξ - потенциала, т.е. еще до достижения системой изоэлектрического состояния.При определ условиях процесс коагуляции может оказаться обратимым, и образовавшийся коагулят вновь может перейти в золь. Этот процесс наз пептизацией. Пептизация тем вероятнее, чем выше гидрофильность осажденного золя, и легче происходит в свежеосажденной системе с рыхлой структурой осадка. Причиной пептизации может быть введение в систему электролита с потенциалообразующими ионами, которые, адсорбируясь на частицах осадка, сообщают им заряд. В такой системе возрастает ξ -потенциал, одноименно заряженные частицы отталкиваются друг от друга и начинают переходить в раствор. Поверхностное натяжение Адсорбция на границе жидкость — газ. Явления адсорбции в жидкости обусловл ее поверхностным натяжением. Пов натяжение в жидкости — величина, численно равная работе, которая затрач на преодоление сил притяжения между частицами поверхностного слоя при выходе молекул на поверхность. При растворении какого-либо в-ва в жидкости ее поверхностное натяжение, как правило, изменяется. Неорганич соли при растворении в воде несколько повышают величину ее поверхностного натяжения. Органич в-ва, например жирные кислоты, спирты, кетоны, мыла, протеины, весьма значительно понижают поверхностное натяжение воды. Вещества, вызывающие резкое понижение поверхностного натяжения, называются поверхн-активными. В-ва, пониж поверхностное натяжение, адсорбируются поверхностным слоем, т. е. сосредотачиваются в нем в большей конц-ции, чем в остальном объеме р-ра, и тем самым еще сильнее снижают поверхн натяжение. В-ва же, повыш поверхностное натяжение, наоборот, находятся в поверхностном слое в меньшей конц-ции, чем в объеме р-ра (это явление наз отриц адсорбцией). Количественно явление адсорбции опред урав Гиббса, установленным с помощью термодинамических расчетов:
где с — конц-ция растворенного вещества в растворе; Г — избыток его в поверхн слое, моль/см2; Если поверхн натяжение σ умс повышением конц-ции растворенного вещества, то величина Г (поверхностный избыток) положительна, след-но, концентрация растворенного в-ва в поверхностном слое больше, чем в объеме р-ра. Если растворенное вещество увеличивает поверхностное натяжение, то величина Г отрицательна. В этом случае конц-ция растворенного в-ва в поверхностном слое меньше, чем в самом р-ре (отрицат адсорбция). Величину
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 444. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
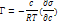
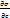 - изменение поверхн натяжения р-ра с концентрацией; R — газовая постоянная, равная 8,314·107 эрг/град·моль; Т—абсолютная температура, К; σ — поверхностное натяжение, эрг/см2.
- изменение поверхн натяжения р-ра с концентрацией; R — газовая постоянная, равная 8,314·107 эрг/град·моль; Т—абсолютная температура, К; σ — поверхностное натяжение, эрг/см2.