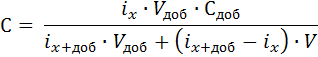Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Измерение массовой концентрации йода методом инверсионной вольтамперометрии ⇐ ПредыдущаяСтр 9 из 9
Принцип определения йода основан на электрохимическом окислении иодид-ионов до молекулярного йода (1), осаждении (в присутствии бромид-ионов и четвертичного основания) малорастворимого комплексного соединения, включающего в свой состав молекулу йода (2), на поверхности рабочего электрода. Затем осадок электрохимически растворяют (3) при линейном наложении потенциала:
2I- - 2e → I2 (1) I2 + Br- → I2Br- I2Br- + R → R[I2Br-] (2) R[I2Br-] + 2e → R + 2I- + Br- (3)
Измеряя величину катодного тока, протекающего при растворении осадка, рассчитывают исходную концентрацию йода в растворе.
Реактивы и оборудование: 1. Вольтамперометрическая установка; 2. Индикаторный электрод – платиновый или стеклоуглеродный электрод; 3. Электрод сравнения – хлорид серебряный электрод; 4. Мерные колбы емкостью 25 мл; 5. Пипетки вместимостью 1 и 5 мл; 6. Фоновый электролит - раствор четвертичного аммонийного основания, 1М раствор серной кислоты, раствор бромистого калия; 7. Раствор исследуемого вещества 8. Растворы иодида калия, 1,0 мг/мл 9. Дистиллированная вода 10. Фильтровальная бумага
Цель работы: Определение массовой концентрации йода методом инверсионной постояннотоковой вольтамперометрии.
Выполнение работы: 1. Регистрация вольтамперограммы фонового электролита. Берут 10 мл фонового раствора, переносят его в стеклянный стаканчик. Погружают в него индикаторный электрод и электрод сравнения и регистрируют вольтамперограмму фона.  2. Приготовление анализируемого раствора. В колбу вместимостью 25 мл последовательно вносят пипетками 0,5 мл раствора четвертичного аммониевого основания, 2,5 мл 1М раствора H2SO4 , 1 мл раствора KBr и 10 мл раствора пробы. Доводят объем раствора в колбе до метки водой, перемешивают и переносят в стакан электрохимической ячейки. 3. Регистрация вольтамперограммы анализируемого раствора после предварительного электрохимического накопления определяемого компонента накопления. Измерения проводят три раза. 4. Регистрация вольтамперограммы анализируемого раствора пробы с добавкой градуировочного раствора KJ. Для этого в стакан с анализируемым раствором вносят пипеткой добавку 0,1 моль/л раствора иодида калия 1 мл и снова снимают вольтамперограмму после предварительного электрохимического накопления определяемого компонента. 5. Массовую концентрацию иодид-ионов в анализируемой пробе рассчитывают по формуле:
где Ix – высота волны (пика) на вольтамперограмме анализируемой пробы, мкА, Ix+доб – высота волны (пика) на вольтамперограмме с добавкой, мкА, Vдоб - объем добавленного раствора определяемого компонента, мл, Сдоб – концентрация добавленного раствора определяемого компонента, моль/ л, V – объем анализирумой пробы, мл, Vдоб – объем добавки, мл. 6. Провести расчеты, сделать вывод.
Решение типовых задач по теме «Вольтамперометрия»
Задача 1. При вольтампероиетрировании стандартных растворов соли цинка определили:
С(Zn2+), % 0,10 0,20 0,30 0,40 0,50 h, мм 8,0 14,0 22,0 28,0 37,0
Используя градуировочный график, вычислите содержание цинка в анализируемом растворе; высота волны (hх) на вольтамперограмме – 25,0 мм.
Решение: Строим график зависимости высоты волны h от содержания цинка (%). По графику находим содержание цинка, которое составляет 0,35 %.
Ответ: 0,35%.
Задача 2. Определите содержание (г) Fe2+ в навеске исследуемого вещества, если после проведения амперометрического титрования раствором
V(K2Cr2O7), мл 0,00 0,20 0,30 0,40 0,50 0,60 0,70 0,80 I, мкА 120 80 60 40 20 10 10 10
Решение: Находим точку эквивалентности по графику амперометрического титрования. Объем раствора K2Cr2O7 в точке эквивалентности 0,55 мл. Рассчитываем содержание Fe2+ в анализируемой навеске исследуемого вещества: m(Fe2+ ) = V(K2Cr2O7) . T(K2Cr2O7/Fe2+) = 0,55 . 2,8 . 10-4 = 1,54 . 10-4 г.
Ответ: 1,54 . 10-4 г.
Вопросы для самоконтроля
1. В чём сущность вольтамперометрических методов анализа? 2. Как взаимосвязаны потенциал полуволны и предельный (диффузионный) ток? 3. Как рассчитать потенциал полуволны на основании вольтамперной кривой? 4. От чего зависит величина предельного тока? 5. На чём основан качественный вольтамперметрический анализ? 6. Какие аналитические приёмы используются в количественной вольтамперометрии? 7. Что представляет собой инверсионная вольтамперометрия? 8. В чём сущность амперометрического титрования? 9. Какой вид имеют кривые амперометрического титрования? 10. Как выбирают условия амперометрического титрования? 11. От чего зависит вид кривой амперометрического титрования?
Список используемой литературы
1. Золотов Ю.А. Основы аналитической химии: в 2 кн.: Кн. 2. Методы химического анализа: учеб. для вузов/ Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. – 2-е изд., перераб. и доп. – М.: Высш. шк., 2002. – 351 с.: ил. 2. Васильев В.П. Аналитическая химия. В 2 кн.: Кн. 2.: Физико-химические методы анализа: учеб. для вузов/В.П. Васильев. – 4-е изд., стереотип. – М.: Дрофа, 2004. – 384 с.: ил 3. Золотов Ю.А. Основы аналитической химии. Практическое руководство: учеб. пособие для вузов/ В.И. Фадеева, Т.Н. Шеховцова, В.М. Иванов и др.; под ред. Ю.А. Золотова –М.: Высш. шк., 2001. – 463 с.: ил. 4. Васильев В.П. Аналитическая химия. Лабораторный практикум.: учеб. пособие для вузов/В.П. Васильев, Р.П. Морозова, Л.А. Кочергина. – 3-е изд., стереотип. – М.: Дрофа, 2006. – 414 с.: ил 5. Коренман Я.И. Практикум по аналитической химии. Анализ пищевых продуктов. В 4-х кн.: кн. 2.: Электрохимические методы анализа: учеб. пособие для вузов/Я.И. Коренман. – М. Колос, 2005. – 232 с.: ил.
|
||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 468. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |