
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Амперометрическое титрование
Метод амперометрического титрования основан на регистрации изменения тока восстановления (окисления) какого-либо из участников химической реакции в ходе титрования:
А (определяемое вещество) + Т (титрант) → Р (продукт)
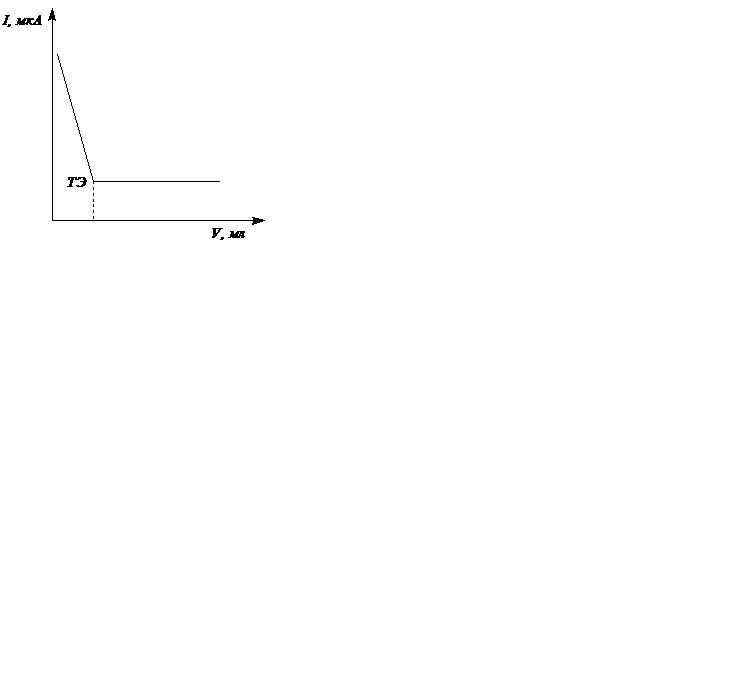
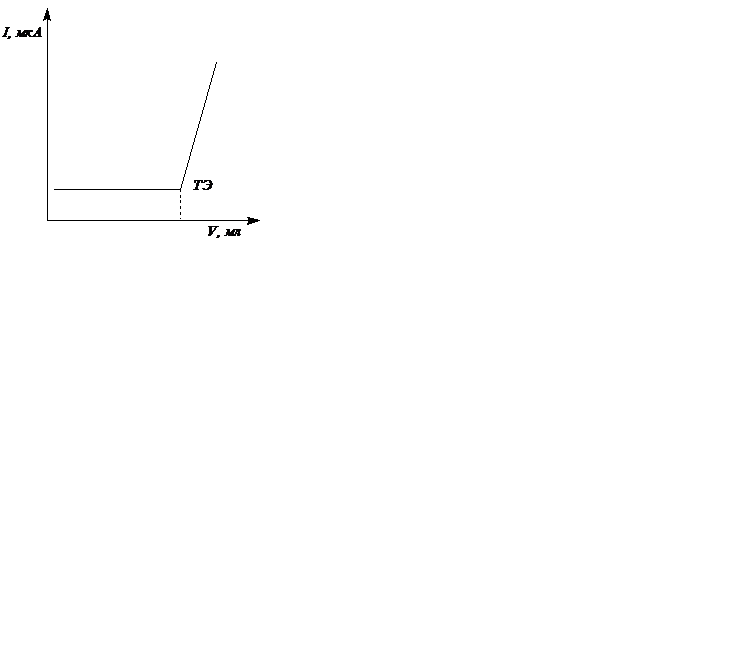
На электроде устанавливают потенциал предельного тока восстановления (окисления) электроактивного участника реакции: А, Т или Р. Кривая титрования состоит из двух линейных участков участков и по положению точки их пересечения на ходят объём титранта, израсходованный на реакцию с определяемым веществом. Вид кривой титрования зависит от того, какой из участников реакции (А,Т или Р) электроактивен при потенциале титрования.
Возможные формы кривых амперометрического титрования: электроактивно определяемое вещество Х (1), титрант Т (2),
В амперометрическом титровании могут быть использованы реакции: а. окисления-восстановления б. комплексообразования в. осаждения
Для выполнения амперометрического титрования в настоящее время в качестве индикаторного электрода используют: а. платиновый электрод б. графитовый электрод Электрод сравнения – каломельный или хлоридсеребряный электрод. Преимущества амперометрического титрования:
1. Амперометрическое титрование характеризуется более высокой точностью и более высокой чувствительностью, чем методы прямой вольтамперометрии. 2. Метод более универсален, так как определяемое вещество не обязательно должно быть электроактивным соединением. 3. Несложное аппаратурное оформление. Достаточно иметь миллиамперметр, делитель и источник постоянного напряжения на 1,5-2 В. 
Практическое применение
Вольтамперометрический метод используют для определения целого ряда металлов. Кадмий, кобальт, медь, свинец, марганец, олово, цинк, железо, висмут, уран, ванадий, таллий и другие металлы можно определить в природных и технических объектах при помощи метода вольтамперометрии. При различиях в потенциалах полуволны Существенное практическое применение имеет вольтамперометрическое определение анионов (хромат-ионы, иодат-ионы, молибдат-ионы …). Многие легко окисляющиеся или восстанавливающиеся органические соединения (альдегиды, кетоны, азо- и нитросоединения) также являются объектами анализа вольтамперометрии.
Лабораторная работа №1
|
||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 497. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 возможно количественное определение элементов без их предварительного разделения.
возможно количественное определение элементов без их предварительного разделения.