
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
При решении задач без выводаКоличество вещества – число структурных элементов (молекул, атомов и т.д.), содержащихся в теле (системе)
где N – число структурных элементов, NА – число Авогадро. Молярная масса вещества:
где m – масса тела. Концентрация молекул
где V – объем тела. Уравнение состояния идеального газа
где р – давление газа, V – его объем, N – количество молекул газав данном объеме, Т - термодинамическая температура, выраженная в кельвинах, k – постоянная Больцмана. Уравнение Менделеева-Клапейрона
где R = 8,31 Опытные газовые законы для двух состояний идеального газа: 1. Закон Бойля-Мариотта (изотермический процесс: Т = const, m = const):
2. Закон Гей-Люссака (изобарный процесс: р = const, m = const):
3. Закон Шарля (изохорный процесс: V=const, m = const):
4. Объединенный газовый закон (m = const):
Закон Дальтона:
где р – давление смеси газов; р1, р2, …, рn – парциальные давления – давления каждой из компонентов смеси. Основное уравнение молекулярно-кинетической теории газа (уравнение, задающее связь между макро - и микропараметрами):
где р – давление газа; п – концентрация молекул газа (число молекул в единице объема); <en> - средняя кинетическая энергия поступательного движения молекулы. Средняя кинетическая энергия молекулы или полная энергия молекулы, приходящаяся на все степени свободы:
где i – число степеней свободы молекулы. Зависимость давления газа от концентрации молекул
Скорости молекул: а) средняя квадратичная
б) средняя арифметическая
в) наиболее вероятная
где т0 – масса одной молекулы; R – универсальная газовая постоянная; m - молярная масса газа, k – постоянная Больцмана, Т – термодинамическая температура.  Средняя длина свободного пробега молекул газа
где n – концентрация молекул, d – эффективный диаметр молекул газа. Среднее число соударений, испытываемых одной молекулой газа в единицу времени
где Связь между удельной с и молярной С теплоемкостями газа
Молярная теплоемкость газа при постоянном давлении Ср и постоянном объеме СV
где i – число степеней свободы молекул идеального газа, R - универсальная газовая постоянная. Уравнение Майера
Первое начало термодинамики
где Q – количество теплоты, сообщаемое системе, DU – изменение внутренней энергии системы, А – работа, совершаемая системой (идеальным газом) против внешних сил. При бесконечно малом сообщении теплоты
где dU – бесконечно малое изменение внутренней энергии системы, dA - элементарная работа, совершаемая газом. Изменение внутренней энергии идеального газа
где i – число степеней свободы молекул; Работа при изменении объема газа в общем случае вычисляется по формуле
где V1 – начальный объем газа, V2 – его конечный объем. Работа газа: а) при изохорном процессе (V = const, m = const)
б) при изобарном процессе (р = const, m = const)
в) при изотермическом процессе (Т = const, m = const)
г) при адиабатном процессе (dQ = 0)
где Уравнения адиабатного процесса для двух состояний идеального газа (уравнения Пуассона):
КПД цикла любой тепловой машины
где A – работа, совершаемая газом за цикл, Q1 – количество теплоты, получаемое рабочим телом (газом) за цикл от нагревателя, Q2 – количество теплоты, отдаваемое за один цикл холодильнику. Термический коэффициент полезного действия цикла Карно:
где Т1 и Т2 – соответственно абсолютные температуры нагревателя и холодильника. Примеры решения задач Пример 1.Определить количество вещества и число молекул, содержащихся в 1г углекислого газа.
Количество вещества:
Число молекул:
Ответ: В одном грамме углекислого газа содержится 2,27×10-2 молей вещества и 1,4×1022 молекул. Пример 2. В баллоне объемом V = 25 л находится водород при температуре Т = 290 К. После того как часть водорода израсходовали, давление в баллоне понизилось на Dр = 0,4 МПа. Определить массу израсходованного водорода.
Масса израсходованного водорода:
где m1, m2 – масса водорода в начальном и конечном состояниях. Из уравнения Менделеева-Клапейрона найдем массу водорода в начальном и конечном состояниях:
Тогда
Проверим размерность полученной формулы:
Делаем расчет:
Ответ: Было израсходовано 8,3 грамма водорода. Пример 3. Количество n = 1 кмоль многоатомного газа нагревается на DТ=100 К в условиях свободного расширения. Найти количество теплоты Q, сообщенное газу, приращение его внутренней энергии DU и работу А, совершаемую газом при расширении.
Количество теплоты, сообщенное газу при изобарном нагревании найдем по формуле:
где
Вычисляя, получим Q=33,24×105 Дж »3,32×106 Дж =3,32 МДж. Приращение внутренней энергии газа
молярная теплоемкость газа при постоянном объеме. Тогда
После вычислений: DU = 2,49 МДж. Согласно первому закону термодинамики: Вычисляя, получим А = 0,83 МДж. Ответ: Количество теплоты, сообщенное газу Q = 3,32 МДж; приращение его внутренней энергии DU = 2,49 МДж; работа, совершенная газом А = 0,83 МДж. Пример 4. Тепловая машина, работающая по циклу Карно, за цикл получает от нагревателя количество теплоты Q1 = 2,5 кДж. Температура нагревателя Т1 = 400 К, температура холодильника Т2 = 300 К. Найти работу А, совершаемую за один цикл и количество теплоты Q2, отдаваемое холодильнику за один цикл.
Термический КПД идеальной тепловой машины где Т1 – температура нагревателя, Т2 – температура холодильника. С другой стороны где А – работа, совершаемая газом за один цикл, Q1 – количество теплоты, полученное от нагревателя; откуда
Вычисляя, получим: А = 0,625 кДж. Известно, что работа, совершаемая за один цикл тогда
Вычисляя, получим Q2 = 1,875 кДж. Ответ: Работа, совершаемая за один цикл А= 0,625 кДж; количество теплоты, отдаваемое холодильнику за один цикл Q2 = 1,875 кДж. Задачи Таблица вариантов к контрольной работе №2
Темы задач(для каждого варианта): в первой задаче - основные положения молекулярно-кинетической теории; во второй – уравнение состояния идеального газа; в третьей –теплоемкость газов; в четвертой – графическое представление изопроцессов идеального газа в параметрических координатах; в пятой – скорости молекул; в шестой – первое начало термодинамики; в седьмой – применение первого начала термодинамики к различным изопроцессам, адиабатный процесс; в восьмой – коэффициент полезного действия тепловых машин. 201. В сосуде вместимостью V = 1 л при нормальных условиях находится азот. Определить количество вещества n и его концентрацию n. 202. В сосуде вместимостью V = 10 л находится кислород массой m = 10 г. Определить концентрацию молекул в сосуде. 203.Найти количество вещества n и число молекул N в капле воды массой 0,1 г. 204. Сколько атомов железа содержится в заготовке массой 200 г? 205.Рассчитайте массу одной молекулы поваренной соли. 206. Рассчитайте массу одной молекулы воды. 207. Найти количество вещества и число атомов в капле ртути массой 1 г. 208. Найти количество вещества n и концентрацию n молекул кислорода массой m = 1 г, занимающего сосуд объемом V = 0,5 л. 209.Определить массу водорода количеством вещества 1 кмоль. 210. Определить молярную массу и массу одной молекулы озона О3. 211. Сосуд объемом V1 = 3 л, содержащий газ под давлением р1 = 200 кПа соединили с другим пустым сосудом объемом V2 = 5 л. Определить установившееся давление при неизменной температуре. 212. Идеальный газ находится в закрытом сосуде при температуре Т1 = 400 К. До какой температуры необходимо охладить газ, чтобы уменьшить его давление в 1,5 раза? 213. В сосуде объемом 1 м3 находится 4 г гелия при температуре 100 оС. Определить его давление. 214. 16 г кислорода при давлении p1 = 200 кПа занимают объем V1 = 5 л. Как изменилась температура газа, если при давлении p2 = 399 кПа его объем уменьшился на 1 л? 215. Как изменится давление идеального газа при увеличении его объема в 2 раза и увеличении его абсолютной температуры в 2 раза? 216. Во сколько раз плотность воздуха зимой при температуре t1 = -13 оС больше его плотности летом при температуре t2 = 27 оС? 217. Найти плотность водорода при температуре 0 оС и давлении 100 кПа. 218. В баллоне находится газ массой m1 = 9 кг при давлении p1= 10 МПа. Когда часть газа выпустили из баллона, давление газа уменьшилось вдвое. Какова масса выпущенного газа? Температуру считать неизменной. 219. Каково количество вещества n газа в баллоне объемом V = 10 м3 при давлении p = 100 кПа и температуре T = 300 К? 220. В баллоне объемом V = 10 л находится m1 = 5 г азота и m2 = 4 г кислорода при температуре t = 27 оС. Каково давление этой газовой смеси? 221. Найти удельные ср и сV и молярные Ср и СV теплоемкости кислорода и азота. 222. Найти удельные ср и сV и молярные Ср и СV теплоемкости гелия и неона. 223. Найти удельные ср и сV и молярные Ср и СV теплоемкости углекислого газа. 224. Удельная теплоемкость двухатомного газа 225. Найти молярные и удельные теплоемкости водяного пара для: а) V = const, б) p = const. 226. Найти показатель адиабаты для: а) неона, б) азота, в) углекислого газа. 227. Найти отношение удельных теплоемкостей ср к сV для кислорода. 228. Чему равны молярные теплоемкости некоторого газа, если его удельные теплоемкости сV = 10,4×103 Дж/(кг×К) и ср = 14,6×103 Дж/(кг×К). 229.Найти число степеней свободы молекул газа, имеющего показатель адиабаты 1,4. 230. Найти удельные теплоемкости газа, молярная масса которого m = 0,03 кг/моль и показатель адиабаты g = 1,4. Сколько атомов входит в состав молекулы этого газа? 231. На рис. 2.1 изображен график процесса, проведенного с идеальным газом, в координатах pV, участок 2-3 – гипербола. Изобразить этот процесс в координатах рТ и VT. 232.На рис. 2.2 изображен график процесса, проведенного с идеальным газом в координатах pV, участки 2-3 и 4-1 – гиперболы. Изобразить этот процесс в координатах pT и VT. 233. На рис. 2.3 изображен график процесса, проведенного с идеальным газом, в координатах pV, участок 1-2 – гипербола. Изобразить этот процесс в координатах pT и VT. 234. На рис. 2.4 изображен в координатах pV график процесса, проведенного с идеальным газом, участки 1-2 и 3-4 – гиперболы. Изобразить этот процесс в координатах pT и VT. 235. На рис. 2.5 изображен в координатах pV график процесса, проведенного с идеальным газом, участки 1-2 и 3-4 – гиперболы. Изобразить этот процесс в координатах pT и VT. 236. На рис. 2.6 изображен в координатах TV график процесса, проведенного с идеальным газом. Изобразить этот процесс в координатах pV и pT. 237.На рис. 2.7 изображен в координатах VT график процесса, проведенного с идеальным газом. Изобразить этот процесс в координатах pV и pT. 238. На рис. 2.8 изображен в координатах VT график процесса, проведенного с идеальным газом. Изобразить этот процесс в координатах pV и pT. 239. На рис. 2.9 изображен в координатах Tp процесс, проведенный с идеальным газом. Изобразить этот процесс в координатах pV и VT. 240. На рис. 2.10 изображен в координатах TV процесс, проведенный с идеальным газом. Изобразить этот процесс в координатах pV и pT. 241.Найти среднюю квадратичную скорость молекул азота и кислорода при нормальных условиях. 242.Найти отношение средних квадратичных скоростей молекул азота и кислорода при одинаковых температурах. 243.Предполагая, что фотосфера Солнца состоит в основном из атомарного водорода и имеет температуру Т = 6000 К, рассчитайте среднюю квадратичную скорость атомов водорода. 244. При какой температуре средняя квадратичная скорость молекул азота будет равна первой космической скорости (VI = 7900 м/с)?
245. Какой должна быть температура гелия, чтобы его молекулы имели такую же скорость, что и молекулы водорода при 0 °С? 246.Как изменится средняя квадратичная скорость и средняя кинетическая энергия теплового движения молекул идеального газа при возрастании абсолютной температуры в 2 раза? 247.Какизменитсядавление идеального газа, если концентрация его молекул и их средняя квадратичная скорость возрастут вдвое? 248. Найти среднюю квадратичную скорость молекул газа, имеющего плотность r = 0,082 кг/м3 при нормальных условиях. 249.Определить температуру водорода и среднюю квадратичную скорость его молекул, если при концентрации молекул n =1025 м-3 он создает давление p = 120 кПа. 250.Найти концентрацию n молекул водорода при давлении p = 100 кПа, если средняя квадратичная скорость его молекул <Vкв> = 500 м/с. 251. Найти изменение внутренней энергии DU идеального газа при изобарном процессе, если газ получил от нагревателя Q1 = 20 кДж тепловой энергии. Увеличилась или уменьшилась внутренняя энергия. Газ считать: 1) одноатомным; 2) двухатомным; 3) многоатомным. 252.Определить, какое количество теплоты было сообщено азоту, заключенному в сосуде объемом V = 200 л, если его давление повысилось на Dp = 1 МПа. 253.10 г водорода, находящегося при температуре -73 °С при постоянном давлении, увеличивают свой объем вдвое за счет подведения к нему тепла извне. Найти количество подведенного тепла Q, изменение внутренней энергии DU и работу расширения A. 254.В закрытом сосуде объемом V = 1 л находится азот, имеющий плотность r = 3 кг/м3. Какое количество теплоты необходимо сообщить азоту, чтобы нагреть его от 0 °С до 100 °С? 255. 2 кмоль углекислого газа изобарно нагреваются на 50 К. Найти количество теплоты, переданной газу, изменение внутренней энергии и работу расширения. 256. В закрытом сосуде находятся m1 = 28 г азота и m2 = 32 г кислорода. Найти изменение внутренней энергии DU при охлаждении газовой смеси на Dt =10 °С. 257. Азот массой m = 30 г находится при температуре T = 200 К. Какое количество теплоты необходимо сообщить азоту, чтобы повысить его абсолютную температуру вдвое при изобарном нагревании? Какую работу при этом совершит газ и как изменится его внутренняя энергия? 258. Какое количество теплоты необходимо сообщить азоту объемом V = 10 л, чтобы при его изохорном нагревании давление возросло на Dp = 100 кПа? 259. Какое количество теплоты необходимо сообщить азоту объемом V = 10 л, находящегося под давлением p = 1 МПа, чтобы изобарно увеличить его объем вдвое? 260. Какое количество теплоты необходимо сообщить азоту объемом V=10 л, находящегося под давлением p = 0,5 МПа, чтобы изохорно увеличить его давление вдвое? 261.Во сколько раз изменилось давление азота массой m = 10 г, находившегося при температуре Т = 300 К, если при этом была совершена работа A = 1 кДж? Процесс протекал при постоянной температуре. 262. На сколько изменится температура газа при адиабатном сжатии 1 кмоль двухатомного газа, если при этом была совершена работа A = 146 кДж? 263. 10 г кислорода, находящегося при нормальных условиях, сжимаются до 1 л. Найти температуру и давление кислорода после изотермического сжатия. 264.10 г азота, находящегося при нормальных условиях, адиабатно сжимаются до 1 л. Найти температуру и давление кислорода после адиабатного сжатия. 265. Кислород, занимающий объем V1 = 5 л при давлении p1 = 1 МПа, расширили в 3 раза. Определить установившееся давление и работу, совершенную газом, если процесс протекал изотермически. 266. Кислород, занимающий объем V1 = 5 л при давлении p1 = 1 МПа, расширили в 3 раза. Определить установившееся давление и работу, совершенную газом, если процесс протекал адиабатно. 267. Азот массой m = 7 г при температуре t = 27 оС изотермически сжимают от давления р1 = 0,1 МПа до давления р2 = 0,5 МПа. Определить количество выделившейся теплоты Q, изменение внутренней энергии DU и работу сжатия А. 268. В результате адиабатного сжатия давление азота массой 1 кг увеличили в 3 раза. Найти конечный объем азота, изменение его внутренней энергии, если первоначальный объем азота был 0,5 м3 и его температура 300 К. 269. Гелий, находившийся при нормальных условиях, изотермически расширяется от V1 = 1 л до V2 = 2 л. Найти работу, совершенную газом при расширении и количество теплоты, сообщенное газу. 270. Работа расширения идеального двухатомного газа равна 2 кДж. Определить подведенное газу количество теплоты при изотермическом процессе. 271. Идеальный газ, совершающий цикл Карно совершил работу A = 1 кДж. Температура нагревателя Т1 = 500 К, температура холодильника Т2 на 200 К ниже температуры нагревателя. Определить КПД цикла и количество теплоты, отданное за цикл холодильнику. 272. Найти максимальное значение КПД идеальной тепловой машины, если в качестве нагревателя используется кипящая при нормальных условиях вода, а в качестве холодильника тающий лед? 273. На сколько изменится КПД идеальной тепловой машины при повышении температуры нагревателя в n раз, если температура холодильника останется прежней? 274. Температура нагревателя 400 К, холодильника 300 К. Во сколько раз увеличится КПД идеальной тепловой машины при повышении температуры нагревателя на 200 К? 275. Идеальная тепловая машина за один цикл получает от нагревателя 6 кДж теплоты, отдавая холодильнику 75% теплоты. Чему равен КПД этой машины? Какую работу она совершает за цикл? 276. Идеальная тепловая машина получает от нагревателя, имеющего температуру T1 = 500 К, за один цикл Q1 = 3,4 кДж теплоты. Найти работу машины за один цикл и количество теплоты, отдаваемое холодильнику, имеющему температуру T2 = 300 К. 277. Идеальный газ, совершающий цикл Карно отдает холодильнику 70% количества теплоты, полученной от нагревателя. Определить термический КПД цикла и работу, совершаемую газом за один цикл, если количество теплоты, полученное от нагревателя равно 7 кДж. 278. Какой КПД имела бы идеальная тепловая машина, работающая по циклу Карно, если бы ее нагреватель был нагрет до температуры T1 = 2700 К, которая может быть получена при сгорании бензина, а холодильником служил бы окружающий воздух при температуре T2 = 300 К? 279. Какую работу совершает идеальная тепловая машина, имеющая нагреватель при температуре t1 = 527 оС и холодильник с температурой t2 = 27 оС, если от нагревателя она получила Q1 = 10 МДж теплоты? 280. В идеальной тепловой машине за счет каждого килоджоуля теплоты, получаемой от нагревателя, совершается работа, равная 300 Дж. Какую температуру имеет нагреватель такой машины, если ее холодильник имеет температуру 17 оС?
Электростатика. Постоянный электрический ток |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 971. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 ,
, ,
, ,
,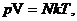
 ,
, - универсальная газовая постоянная.
- универсальная газовая постоянная. .
. .
. .
. .
. ,
, ,
, ,
, .
. ,
,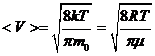 ,
, ,
, ,
,
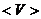 - средняя арифметическая скорость молекул.
- средняя арифметическая скорость молекул. .
. ,
, .
. ,
, ,
, ,
, - количество вещества.
- количество вещества.
 ,
,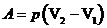 ,
,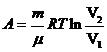 ,
,
 – показатель адиабаты.
– показатель адиабаты.
 ,
, ,
, Решение:
Решение: .
. .
. Решение:
Решение: ,
, .
.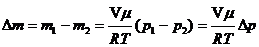 .
.

 Решение:
Решение:  ,
, - молярная теплоемкость газа при постоянном давлении, i – число степеней свободы молекулы. Исходя из этого
- молярная теплоемкость газа при постоянном давлении, i – число степеней свободы молекулы. Исходя из этого .
. , где
, где  -
- .
. .
. Решение:
Решение: ,
, ,
, .
. ,
, .
. , какова его молярная масса?
, какова его молярная масса?