
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Адсорбция на поверхности раздела жидкость – газДля интерпретаций явлений адсорбции на границе раствор — газ весьма существенно установить связь между избытком адсорбированного вещества в поверхностном слое Г, концентрацией поверхностно-активного вещества в растворе с и поверхностным натяжением а на границе раствор — газ. Эта связь для разбавленных растворов дается известным уравнением адсорбции Гиббса, выведенным им в 1876 г.:
Уравнение адсорбции Гиббса устанавливает взаимосвязь адсорбции с концентрацией вещества в растворе и его поверхностной активностью. Поверхностная активность вещества, а значит, и адсорбция зависит от ряда факторов. 1. Природы вещества: ПАВ будут накапливаться в поверхностном слое (положительная адсорбция); поверхностно-инактивные вещества, наоборот, удаляться из поверхностного слоя (отрицательная адсорбция), если вещество не влияет на поверхностное натяжение, то адсорбции не наблюдается. 2. Полярности молекулы: уменьшение полярности молекулы приводит к росту поверхностной активности, а следовательно, к увеличению адсорбции.
Рис. 22. Вид изотерм адсорбции для различных гомологов (n – условная длина углеводородного радикала) и ориентация молекул ПАВ. 3. Строения молекулы: для членов одного гомологического ряда увеличение длины углеводородного радикала на одно звено (−СН2−) приводит к увеличению поверхностной активности водных растворов этих веществ в 3 – 3,5 раза, при этом величина предельной адсорбции остается постоянной (эмпирическое правило Дюкло-Траубе). Математически правило Дюкло-Траубе может быть записано в виде следующего уравнения: 
Правило Дюкло-Траубе объясняется определенной ориентацией молекул ПАВ в поверхностном слое (И. Ленгмюр, 1915 г.). При адсорбции полярная группа втягивается в полярный растворитель, например, в воду, а неполярный радикал выталкивается в неполярную фазу, например, в воздух (см. рис. 12). Происходящее при этом уменьшение поверхностной энергии ограничивает толщину поверхностного слоя размером с молекулу адсорбтива. Из-за вертикальной ориентации молекул ПАВ в поверхностном слое максимальная адсорбция Г∞ не зависит от длины углеводородного радикала, а определяется только размерами поперечного сечения молекулы, которые в данном гомологическом ряду не меняются.
Рис. 23. Построение изотермы адсорбции по изотерме поверхностного натяжения Пользуясь уравнением Гиббса, по изотерме поверхностного натяжения для поверхностно-активного вещества легко построить соответствующую изотерму адсорбции следующим образом. Возьмем какую-нибудь точку на изотерме поверхностного натяжения и проведем через нее касательную и прямые, параллельные осям координат, как это показано на рис. 13. Отрезок, отсекаемый на оси ординат касательной и прямой, параллельной оси концентраций, деленный на отрезок абсциссы, отсекаемый на ней прямой, проведенной через точку параллельно оси ординат, равен −C(dσ/dC), т. е.
Подставив значение, найденное для −dσ/dC, в уравнение Гиббса, получим:
Определив для ряда точек изотермы поверхностного натяжения соответствующие значения величины Г, легко построить изотерму адсорбции. Кроме того, для нахождения производной d/dC можно воспользоваться эмпирическим уравнением Б.А. Шишковского, полученным им в 1908 г.
где σ0 и σi – поверхностное натяжение чистого растворителя и раствора соответственно; a и b – эмпирические константы. Уравнение Шишковского хорошо применимо для вычисления поверхностного натяжения жирных кислот с не слишком большим числом атомов углерода в молекуле (до С8). Из уравнения Шишковского следует, что
После подстановки в уравнение изотермы адсорбции Гиббса получим:
Теоретическое обоснование эмпирическое уравнение Б.А. Шишковского получило в рамках теории мономолекулярной адсорбции И. Ленгмюра (1917 г.), основные положения которой приведены ниже. =При адсорбции образуется насыщенный мономолекулярный слой адсорбированного вещества. =Адсорбция является квазихимическим процессом взаимодействия между адсорбатом и адсорбентом, который можно описать с помощью величин, характеризующих химическую реакцию (тепловой эффект, энергия Гиббса, константа скорости процесса и т. п.), но при этом превращение веществ отсутствует. =При адсорбции молекулы не могут перемещаться по поверхности, т.е. она локализована. =Адсорбированные молекулы не взаимодействуют друг с другом. Уравнение адсорбции Ленгмюра имеет вид:
Тогда константа а уравнения Шишковского связана с величиной предельной адсорбции: а = Г∞RT; постоянная b имеет физический смысл константы равновесия процесса адсорбции. По величине Г∞ можно рассчитать размеры молекул ПАВ: площадь поперечного сечения где NA – число Авогадро; длину молекулы где МПАВ – молярная масса ПАВ, dПАВ – плотность раствора ПАВ. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 484. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
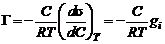 для разбавленных растворов
для разбавленных растворов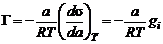 для концентрированных растворов.
для концентрированных растворов.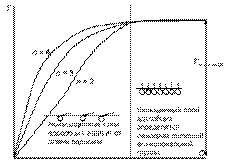
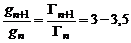 .
.
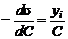 .
.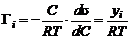 .
.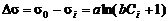 ,
,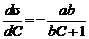 .
.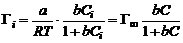 .
.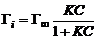 .
.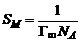 ,
,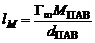 ,
,