Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Основные отличия гетерохроматина от эухроматина.1) Плотная упаковка ДНК. В топологически разомкнутой ДНК не может существовать торсионное напряжение. Различия в упаковке эу- и гетерохроматиновых блоков метафазных хромосом выявляются не только при окраске по Гимза (G- и С-полосы), но также при использовании электронного или фазово-контрастного микроскопа. По завершении митоза компактное состояние ДНК частично сохраняется и проявляется в виде хромоцентров интерфазного ядра. Плотная упаковка ДНК деконденсируется холодом и колцемидом. 2) Поздняя репликация ДНК. В настоящее время принято считать, что это не запаздывание репликации ДНК гетерохроматина в S-периоде клеточного цикла, а просто ДНК гетерохроматина имеет другое расписания репликации. 3) Подавлена транскрипция (инактивация Х хромосомы?). В качестве доказательства приводится пример: ядра покоящихся лимфоцитов периферической крови почти полностью гетерохроматизированы и транскрипционно неактивны. 4) Гетерохроматин вызывает эффект положения гена. В рамках обсуждаемой гипотезы автор утверждает, что ген, попавший в блок гетерохроматина, должен быть инактивирован, потому что разрывы в его ДНК будут индуцированы одновременно с индукцией разрывов в молекулах ДНК всего блока в процессе его гетерохроматинизации. 5) Склонность к агрегации (липкость). Неоднократно отмечалась упорядоченность хромосом в митозе, приписываемая «притяжению» между гетерохроматиновыми районами гомологов. Описана конъюгация гетерохроматиновых районов сестринских хроматид [2, 3]. В политенных ядрах нередко образуются эктопические контакты между блоками интеркалярного гетерохроматина разных хромосом [4].  Все эти проявления липкости могут быть следствием образования гибридных ДНК, включающих в себя однонитевые участки двух разных блоков гетерохроматина. 6) Высокая частота локализации концов перестроек хромосом. Общепринято, что хромосомная перестройка получается после разрыва пары внутри- или межхромосомных связей, инверсии концов и их последующего восстановления. Автор гипотезы предполагает, что наличие однонитевых разрывов с «липкими» концами в гетерохроматиновой ДНК заметно облегчает образование гибридных участков и тем самым увеличивает частоту перестроек, концы которых оказываются локализованными в блоках гетерохроматина 7) Формируется в онтогенезе через разрывы ДНК. Процесс формирования гетерохроматина в раннем развитии животных достаточно продолжителен и сопряжен с разрывами ДНК. У самок мышей гетерохроматинизация Х-хромосомы происходит в те же сроки, и тем же механизмом, что и формирование гетерохроматина. 8) Вариабельность количества ДНК. 9) Гетерохроматин обогащен повторами и мобильными генетическими элементами. 10) Подавлена рекомбинация в мейозе. В2.Изменения нуклеотидных последовательностей ДНК. Генные мутации. Мутации по типу замены азотистых оснований. Эти мутации происходят в силу ряда конкретных причин. Одной из них может быть возникающее случайно или под влиянием конкретных химических агентов изменение структуры основания, уже включенного в спираль ДНК. Если такая измененная форма основания остается не замеченной ферментами репарации, то при ближайшем цикле репликации она может присоединять к себе другой нуклеотид. Примером может служить дезаминирование цитозина, превращающегося в урацил самопроизвольно или под влиянием азотистой кислоты (рис. 3.18). Образующийся при этом урацил, не замеченный ферментом ДНК-гликозилазой, при репликации соединяется с аденином, который впоследствии присоединяет тимидиловый нуклеотид. В результате пара Ц—Г замещается в ДНК парой Т—А (рис. 3.19, I). Дезаминирование метилированного цитозина превращает его в тимин (см. рис. 3.18). Тимидиловый нуклеотид, являясь естественным компонентом ДНК, не обнаруживается ферментами репарации как изменение и при следующей репликации присоединяет адениловый нуклеотид. В результате вместо пары Ц—Г в молекуле ДНК также появляется пара Т—А. Другой причиной замены оснований может быть ошибочное включение в синтезируемую цепь ДНК нуклеотида, несущего химически измененную форму основания или его аналог. Если эта ошибка остается не замеченной ферментами репликации и репарации, измененное основание включается в процесс репликации, что нередко приводит к замене одной пары на другую. Примером этого может служить присоединение в ходе репликации к аденину материнской цепи нуклеотида с 5-бромурацилом (5-БУ), аналогичного тимидиловому нуклеотиду. При последующей репликации 5-БУ охотнее присоединяет к себе не аденин, а гуанин. Гуанин в ходе дальнейшего удвоения образует комплементарную пару с цитозином. В итоге пара А—Т заменяется в молекуле ДНК парой Г—Ц . Из приведенных примеров видно, что изменения структуры молекулы ДНК по типу замены оснований возникают либо до, либо в процессе репликации первоначально в одной полинуклеотидной цепи. Если такие изменения не исправляются в ходе репарации, то при последующей репликации они становятся достоянием обеих цепей ДНК. В3.Токсоплазма. Морфофункциональная характеристика: цикл развития, пути заражения, патогенное действие, методы лабораторной диагностики. Токсоплазма (лат. Toxoplasma) — монотипный род паразитическихпротозоев, включающий, видимо, один вид — Toxoplasma gondii. Основные хозяева токсоплазм — представители семейства кошачьих. В качестве промежуточных хозяев выступают различные виды теплокровных животных, в том числе и люди. Токсоплазмоз, болезнь, вызываемая токсоплазмой, обычно протекает у человека легко. Однако для плода, в случае если мать заразилась токсоплазмозом во время беременности, а также для человека или кошки с пониженным иммунитетом эта болезнь может иметь серьёзные последствия, вплоть до летального исхода. Toxoplasma gondii принадлежит к типу Apicomplexa и является единственным описанным видом родаToxoplasma. Тем не менее, высказывалась гипотеза, что на самом деле может существовать несколько видов токсоплазм[ Жизненный циклToxoplasma gondii состоит из двух фаз. Половая часть жизненного цикла проходит только в особях некоторых видов семейства кошачьих (дикие и домашние кошки), которые становятся первичным хозяином паразитов. Бесполая часть жизненного цикла может проходить в любом теплокровном животном, например, в млекопитающих (и в кошках тоже) и в птицах. В этих промежуточных хозяевах паразит вторгается в клетки, формируя так называемые межклеточные паразитофорные вакуоли, содержащие брадизоиты, медленно воспроизводящиеся формы паразита[2]. Вакуоли формируют тканевые цисты, в основном, в мышцах и в мозге. Так как паразит находится внутри клеток, то иммунная система хозяина не может обнаружить эти цисты. Сопротивляемость к антибиотикам различна, но цисты очень трудно вывести из организма полностью. Внутри этих вакуолей T. gondii размножается последовательностью делений на две части до тех пор, как инфицированная клетка в конце концов не лопается и тахизоиты не выходят наружу. Тахизоиты подвижны и бесполым способом размножаются, производя новых паразитов. В отличие от брадизоитов, свободные тахизоиты легко устраняются иммунной системой хозяина, но при этом могут заразить клетки и сформировать брадизоиты, тем самым поддерживая инфекцию. Тканевые цисты проглатываются кошкой (например, когда она съедает заражённую мышь). Цисты выживают в желудке кошки, и паразиты заражают эпителиальные клетки тонкой кишки, где они приступают к половому размножению и формированию ооцист. Ооцисты выходят наружу с фекалиями. Животные (в том числе, люди) проглатывают ооцисты (например, поедая немытые овощи и т. д.) или тканевые цисты (в плохо приготовленном мясе) и заражаются. Паразиты внедряются в макрофаги в кишечном тракте и через кровь распространяются по телу.
Заражение токсоплазмой в острой стадии может быть бессимптомным, но часто вызывает симптомы гриппа на раннеострых стадиях, и, как и грипп, может в редких случаях привести к смерти. Острая стадия спадает за период от нескольких дней до месяцев, переходя в хроническую стадию. Хроническая инфекция обычно бессимптомна, но в случае иммунноослабленных пациентов (а также пациентов, заражённых ВИЧ, или пациентов, проходящих иммунноподавляющую терапию после пересадки органов) токсоплазмоз может развиваться. Наиболее частым проявлением токсоплазмоза у иммунноослабленных пациентов является токсоплазмозный энцефалит, который может привести к смерти. Если заражение T. gondii возникает впервые во время беременности, то паразит может проникнуть через плаценту, заразить плод, что может привести к гидроцефалии, внутричерепному обызвествлению или к хориоретиниту, а также к самопроизвольному аборту или внутриутробной смерти. Было доказано, что паразит может влиять на поведение хозяина: заражённые крысы и мыши меньше боятся кошек; замечены факты того, что заражённые крысы сами ищут места, где мочилась кошка. Этот эффект благоприятен для паразита, который сможет размножаться половым способом, если его хозяин будет съеден кошкой[3]. Механизм этого изменения ещё до конца не изучен, но существуют доказательства того, что токсоплазмоз повышает уровень дофамина у заражённых мышей. Существует несколько независимых наблюдений, подтверждающих роль заражения токсоплазмой в случаях проявления шизофрении и паранойи[5]:
Активным исследователем роли токсоплазмы и других инфекций при шизофрении является американский психиатр Фуллер Тори. Билет 66 В1. Уровни структурной организации хроматина Сохраняя преемственность в ряду клеточных поколений, хроматин в зависимости от периода и фазы клеточного цикла меняет свою организацию. В интерфазе при световой микроскопии он выявляется в виде глыбок, рассеянных в нуклеоплазме ядра. При переходе клетки к митозу, особенно в метафазе, хроматин приобретает вид хорошо различимых отдельных интенсивно окрашенных телец — хромосом. Интерфазную и метафазную формы существования хроматина расценивают как два полярных варианта его структурной организации, связанных в митотическом цикле взаимопереходами. В пользу такой оценки свидетельствуют данные электронной микроскопии о том, что в основе как интерфазной, так и метафазной формы лежит одна и та же элементарная нитчатая структура. В процессе электронно-микроскопических и физико-химических исследований в составе интерфазного хроматина и метафазных хромосом были выявлены нити (фибриллы) диаметром 3,0—5,0, 10, 20—30 нм. Полезно вспомнить, что диаметр двойной спирали ДНК составляет примерно 2 нм, диаметр нитчатой структуры интерфазного хроматина равен 100—200, а диаметр одной из сестринских хроматид метафазной хромосомы — 500— 600 нм. Наиболее распространенной является точка зрения, согласно которой хроматин (хромосома) представляет собой спирализованную нить. При этом выделяется несколько уровней спирализации (компак-тизации) хроматина (табл. 3.2).
Нуклеосомиая нить. Этот уровень организации хроматина обеспечивается четырьмя видами нуклеосомных гистонов: Н2А, Н2В, НЗ, Н4. Они образуют напоминающие по форме шайбу белковые тела — коры, состоящие из восьми молекул (по две молекулы каждого вида гистонов) Молекула ДНК комплектируется с белковыми корами, спирально накручиваясь на них. При этом в контакте с каждым кором оказывается участок ДНК, состоящий из 146 пар нуклеотидов (п.н.). Свободные от контакта с белковыми телами участки ДНК называют связующими или линкерными. Они включают от 15 до 100 п.н. (в среднем 60 п.н.) в зависимости от типа клетки. Отрезок молекулы ДНК длиной около 200 п. н. вместе с белковым кором составляет нуклеосому. Благодаря такой организации в основе структуры хроматина лежит нить, представляющая собой цепочку повторяющихся единиц — нуклеосом (рис. 3.46, Б). В связи с этим геном человека, состоящий из 3 · 109 п. н., представлен двойной спиралью ДНК, упакованной в 1,5 · 107 нуклеосом. Вдоль нуклеосомной нити, напоминающей цепочку бус, имеются области ДНК, свободные от белковых тел. Эти области, расположенные с интервалами в несколько тысяч пар нуклеотидов, играют важную роль в дальнейшей упаковке хроматина, так как содержат нуклеотидные последовательности, специфически узнаваемые различными негистоновыми белками.В результате нуклеосомной организации хроматина двойная спираль ДНК диаметром 2 нм приобретает диаметр 10—11 нм.
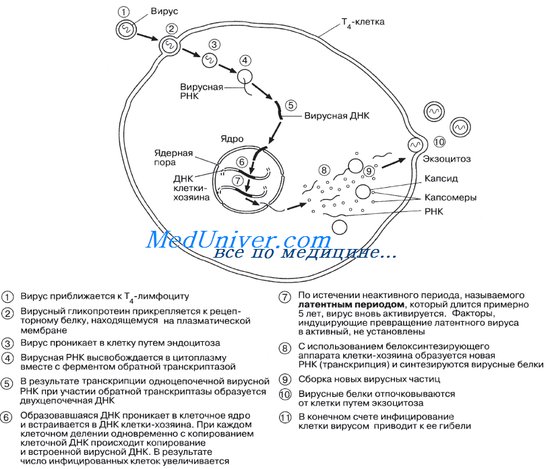
Интерфазная хромонема. Следующий уровень структурной организации генетического материала обусловлен укладкой хроматиновой фибриллы в петли. В их образовании, по-видимому, принимают участие негистоновые белки, которые способны узнавать специфические нуклеотидные последовательности вненуклеосомной ДНК, отдаленные друг от друга на расстояние в несколько тысяч пар нуклеотидов. Эти белки сближают указанные участки с образованием петель из расположенных между ними фрагментов хроматиновой фибриллы (рис. 3.48). Участок ДНК, соответствующий одной петле, содержит от 20 000 до 80 000 п. н. Возможно, каждая петля является функциональной единицей генома. В результате такой упаковки Хроматиновая фибрилла диаметром 20—30 нм преобразуется в структуру диаметром 100—200 нм, называемую интерфазной хромонемой. Метафазная хромосома. Вступление клетки из интерфазы в митоз сопровождается суперкомпактизацией хроматина. Отдельные хромосомы становятся хорошо различимы. Этот процесс начинается в профазе, достигая своего максимального выражения в метафазе митоза и анафазе (см. разд. 2.4.2). В телофазе митоза происходит декомпак-тизация вещества хромосом, которое приобретает структуру интерфазного хроматина. Описанная митотическая суперкомпактизация облегчает распределение хромосом к полюсам митотического веретена в анафазе митоза. В2.Механизмы онкогенеза.Наше тело состоит из бесчисленного числа различных клеток. Клетки очень различаются по строению и функции: клетки кожи, нервов, сердца, легких, крови, иммунной системы совершенно различны. Однако, вне зависимости от «профессии», все клетки умеют делится и созревать из своих более ранних предшественников (иначе как они могли возникнуть?). Кроме того, все клетки умеют погибать вовремя. Их гибель не случайна и тщательно контролируется: организм точно регулирует численность клеток в тканях. Запрограммированная гибель клеток называется апоптоз. Эти три свойства - деление, созревание и апоптоз совершенно необходимы для жизни клеток в большом многоклеточном организме. Вместе с тем, нарушения этих трех основ жизнедеятельности клетки приводят к развитию опухолей. Накопление опухолевых клеток происходит из за того, что они бесконтрольно делятся, либо из за того, что они не могут созреть и превратиться в своих высоко-профессиональных потомков («заморожены» на стадии развития), либо из за того, что они не могут умереть вовремя. Кроме того, опухоль всегда клональна. Это означает, что все клетки опухоли произошли из одной и представляют собой точные копии (клоны) исходной клетки. Строго говоря, все клетки организма клональны - ведь они возникли из зиготы, образовавшейся после слияния сперматозоида и яйцеклетки. Но во время роста и созревания организма клетки сильно специализируются и становятся совсем не похожи одна на другую. Так, «профессия» лимфоцитов - защищать нас от инфекций. Лимфоциты отличаются друг от друга тем, что отвечают на разных возбудителей, а также своей ролью в иммунной системе. Поскольку деление, созревание и запрограммированная смерть свойственны всем клеткам, опухоль может развиться практически из любого типа клеток, в том числе из лимфоцитов. Нарушения деления, созревания и запрограммированной гибели возникают из-за повреждений генов. Клетки имеют множество встроенных систем защиты против этих внутренних генетических ошибок, но эти защитные системы могут ошибаться, поврежденная клетка выживает и образует множество себе подобных (клонов). Повреждения некоторых генов могут наследоваться, предрасполагая к опухоли. В3Вопросы радиационной безопасности человека. Последствия аварии на Чернобыльской АЭС. Вред радиоактивных элементов и воздействие радиации на человеческий организм активно изучается учёными всего мира. Доказано, что в ежедневных выбросах из АЭС содержится радионуклид «Цезий-137», который при попадании в организм человека вызывает саркому (разновидность рака), «Стронций-90» замещает кальций в костях и грудном молоке, что приводит к лейкемии (раку крови), раку кости и груди. А даже малые дозы облучения «Криптоном-85» значительно повышают вероятность развития рака кожи. Сотрудники www.dozimetr.biz отмечают, что наибольшему воздействию радиации подвергаются люди, проживающие в крупных городах, ведь помимо естественного радиационного фона на них ещё воздействуют стройматериалы, продукты питания, воздух, зараженные предметы. Постоянное превышение над естественным радиационным фоном приводит к раннему старению, ослаблению зрения и иммунной системы, чрезмерной психологической возбудимости, гипертонии и развитию аномалий у детей. аже самые малые дозы облучения вызывают необратимые генетические изменения, которые передаются из поколения в поколение, приводят к развитию синдрома Дауна, эпилепсии, появлению других дефектов умственного и физического развития. Особо страшно то, что радиационному заражению подвергаются и продукты питания, и предметы быта. В последнее время участились случаи изъятия контрафактной и низкокачественной продукции, являющейся мощным источником ионизирующего излучения. Радиоактивными делают даже детские игрушки! О каком здоровье нации может идти речь?! Единственный способ хоть как-то обезопасить себя и своих близких от смертельного воздействия — купить дозиметр радиации. С ним Вы сможете за считанные секунды проверить безопасность детских игрушек, продуктов питания, ювелирных украшений и всего того, что приносите в дом, с чем играют ваши дети. Доказано, что последствия облучения крайне тяжело лечить, зато постараться максимально защитить себя и свою семью от этого в ваших силах. 4,А-собачий клещ Билет 67 В1.Первый уровень компактизации ДНК. Структурная роль нуклиосом. Нуклиосомы при репликации. Политенные хромосомы. В ранних биохимических и электронномикроскопических работах было показано, что препараты ДНП содержат нитчатые структуры с диаметром от 5 до 50 нм. Постепенно стало ясно, что диаметр фибрилл хроматина зависит от способа выделения препарата. На ультратонких срезах интерфазных ядер и митотических хромосом после фиксации глутаровым альдегидом обнаруживались хроматированные фибриллы толщиной 30 нм. Такие же размеры имели фибриллы хроматина при физической фиксации ядер - при быстром замораживании ядер, скалывании объекта и получении реплик с таких препаратов. В последнем случае исключалось воздействие на хроматин переменных химических условий. Но все эти методы и приемы не давали никакой информации о характере локализации ДНК и гистонов в хроматиновых фибриллах. Крупным событием в изучении хроматина было открытие двумя разными способами нуклеосом - дискретных частиц хроматина. Так при осаждении на подложку для электронной микроскопии препаратов хроматина в щелочных условиях при низкой ионной силе, можно было видеть, что нити хроматина представляли собой что-то, напоминающее "бусы на нитке": небольшие, около 10 нм, глобулы, связанные друг с другом отрезками ДНК длиной около 20 нм. Эти наблюдения совпадали с результатами фракционирования хроматина после частичного нуклеазного переваривания. Было найдено, что если подвергнуть действию нуклеазы микрококков выделенный хроматин, то он подвергается распаду на регулярно повторяющиеся структуры. Так ДНК, полученная из хроматина, обработанного нуклеазой, состояла из серии отрезков, кратных 200 парам оснований; встречались отрезки в 200, 400, 600, 800 и больше пар нуклеотидов (п.н.). Это говорит о том, что нуклеазной атаке в составе хроматина подвергаются участки ДНК, расположенные примерно через каждые 200 п.н. При этом в кислоторастворимую фракцию (низкополимерная) ДНК уходит всего 2% ядерной ДНК. Кроме того после такой нуклеазной обработки из хроматина путем центрифугирования удается выделить фракцию частиц со скоростью седиментации 11S (S - единица Сведберга, определяющая скорость седиментации частиц, равна 1 х 10-13 с), а также частицы кратного этой величине размера: димеры, тримеры, тетрамеры и т.д. Оказалось, что частицы 11S содержат ДНК около 200 п.н. и восемь гистонов (октамер) по две копии гистонов H2A, H2B, H3 и H4 и одну копию гистона H1. Такая сложная нуклеопротеидная частица получила название нуклеосомы. Более подробный анализ этой фракции показал, что нуклеосома устроена следующим образом: октамер гистонов образует белковую основу-сердцевину (от англ. core, часто в нашей литературе этот термин используется без перевода: кор, коровая частица), по поверхности которой располагается ДНК величиной в 146 п.н., образующая 1,75 оборота; остальные 54 п.н. ДНК образуют участок, несвязанный с белками сердцевины - линкер, который, соединяя две соседние нуклеосомы, переходит в ДНК следующей нуклеосомы. Гистон H1 связывается частично с основной, сердцевиной и с участком линкера (около 30 п.н.). Следовательно, полная нуклеосома содержит около 200 п.н. ДНК (146 п.н.- сердцевина, 30 п.н. - участок линкера в комплексе с гистоном H1, 30 п.н. - свободная ДНК), октамер сердцевинных (коровых) гистонов и одну молекулу гистона H1. Молекулярная масса полной нуклеосомы - 262000 Да. Рассчитано, что на весь гаплоидный геном человека (3 х 109 пар оснований) приходится 1,5 х 107 нуклеосом. Сердцевина или коровая частица (или минимальная нуклеосома) очень консервативны по своей структуре: они всегда содержат 146 п.н. ДНК и октамер гистонов. Линкерный участок может значительно варьировать (от 8 до 114 п.н. на нуклеосому). Используя метод рассеяния нейтронов удалось установить форму и точные размеры нуклеосом. При грубом приближении - это плоский цилиндр или шайба диаметром 11 нм и высотой 6 нм. Располагаясь на подложке для электронного микроскопирования они образуют «бусины», глобулярные образования около 10 нм, гуськом, тандемно сидящие на вытянутых молекулах ДНК. На самом же деле вытянутыми являются только линкерные участки, остальные три четверти длины ДНК спирально уложены по периферии гистонового октамера. Сам гистоновый октамер, как считают, имеет форму, напоминающую мяч для игры в рэгби, в состав которого входит тетрамер (H3 · H4)2 и два независимых димера H2A · H2B. В фибриллах хроматина линкерный участок не линеен, а продолжая спираль ДНК на поверхности нуклеосомной частицы,связывает соседние нуклеосомы так, что образуется как бы сплошная нить, толщиной около 10 нм, состоящая из тесно расположенных нуклеосом. При этом за счет дополнительной спирализации ДНК (1 отрицательный супервиток ДНК на 1 нуклеосому) происходит первичная компактизация ДНК, с плотностью упаковки равной 6-7 (200 п.н. длиной 68 нм, уложены в глобулу диаметром 10 нм). Укладка почти двух витков ДНК по периферии сердцевин нуклеосомы происходит, как считается, за счет взаимодействия положительно заряженных аминокислотных остатков на поверхности октамера гистонов с фосфатами ДНК. N- и C-концевые участки сердцевинных гистонов, обогащенные положительными зарядами, вероятно, служат для дополнительной стабилизации структуры нуклеосомы. Ведущая роль сердцевинных (коровых) белков в компактизации ДНК показана при самосборке нуклеосом. Регулируя последовательность добавления гистонов и ДНК, удалось получить полную реконструкцию нуклеосом. В этом процессе не играет никакой роли источник, откуда была взята ДНК: это может быть ДНК бактерии и даже циклическая ДНК вирусов. Оказалось, что для образования нуклеосом гистон H1 не требуется, он участвует в связывании уже готовых нуклеосом друг с другом и в образовании более высоких уровней компактизации ДНК. Ключевыми в построении нуклеосом оказались гистоны H3 и H4. При этом вначале ДНК связывается с тетрамером (H3 · H4)2 к которому позжеприсоединяются два димера H2A · H2B. Вероятно, высокая консервативность в строении гистонов H3 и H4 отражает их ведущую структурную роль на первых этапах компактизации ДНК при образовании нуклеосом. В2 Онкогенные вирусы. Жизненный цикл ретровирусов. Особый интерес среди вирусных болезней вызывает СПИД (синдром приобретенного иммунодефицита человека), поскольку это относительно новая болезнь. Впервые сообщение о ней появилось в США в 1981 г. СПИД вызывается вирусом иммунодефицита человека, или сокращенно ВИЧ. Интерес к этому вирусу объясняется еще и тем обстоятельством, что ВИЧ относится к группе вирусов, получивших название ретровирусов — название, отражающее следующую особенность этого вируса. Обычно перенос генетической информации идет в направлении ДНК—> РНК, т. е. информация, закодированная в определенном отрезке ДНК (гене) транскрибируется, т. е. считывается, с образованием соответствующей РНК. У ретровирусов же, у которых наследуемым генетическим материалом служит РНК, происходит обратная транскрипция, т. е. генетическая информация считывается в обратном направлении: от РНК к ДНК. Фермент, участвующий в обратной транскрипции, называется обратной транскриптазой. Он широко используется в генетической инженерии. ВИЧ инфицирует и разрушает лейкоциты определенной группы, называемые Т-хелперными лимфоцитами, подавляя в результате активность иммунной системы.
В3 Химическое и радиоактивное загрязнение окружающей среды. «Зелёные столицы» Европы. Представленная работа посвящена теме "Загрязнение окружающей среды (в том числе химическое, токсическое и радиоактивное, биологическое и генетическое)". Еврокомиссия учредила новую премию «Зеленая столица Европы», чтобы оценить европейские города с точки зрения экологии, состояния окружающей среды и перспектив развития экотуризма. Но абсолютных победителя оказалось два: Стокгольм станет «Зеленой столицей Европы» в 2010 году и Гамбург – в 2011-м. Столица Швеции, построенная на архипелаге из 14 островов, окружена лесопарковыми оазисами, до которых легко можно добраться из центра города благодаря очень эффективной транспортной системе. Два «зеленых сердца» Стокгольма – Дьюргарден (Djurgården) и Экопаркен (Ekoparken). Экопаркен – первый в мире городской национальный парк, площадью более 30 квадратных километров, имеет особую ценность для экологии. К 2050 году Стокгольм должен полностью перейти на альтернативные источники энергии и стать полностью независимым от невозобновляемых источников энергии, таких как газ, нефть и уголь.Второй по величине европейский порт и самый зеленый город Германии - Гамбург не случайно будет нести звание «Зеленой столицы» в 2011 году. Экологи отмечают эффективные природосберегающие технологии городского хозяйства, а туристы – обилие растений в Гамбурге. Кроме того, расположенный в городе парк Planten un Blomen, включает в себя огромный ботанический сад, тропическую оранжерею и самый обширный в Европе японский сад. А муниципальный Standpark считается самыми большим «зеленым театром» - в парке расположена открытая сцена, а также крупный планетарий. 4,простейшие,саркожгутиконосцы ,класс-жгутиковые,ЛЯМБЛИЯ Кишечная(лямблия интерстиналис).1.-ядро,2-жгутики
Билет 68 В1. Второй и третий уровень организации хромотина. Петлевые домены ДНК - третий уровень структурной организации хроматина Расшифровка принципа строения элементарных хромосомных компонентов - нуклеосом и 30 нм фибрилл - еще мало что дает для понимания основ трехмерной организации хромосом, как в интерфазе, так и в митозе. Сорокакратное уплотнение ДНК, которое достигается при сверхспиральном характере ее компактизации, совершенно еще недостаточно для получения реального (1 х 104) уровня уплотнения ДНК. Следовательно должны существовать более высокие уровни компактизации ДНК, которые в конечном счете должны определять размеры и общие характеристики хромосом. Такие высшие уровни организации хроматина были обнаружены при искусственной его деконденсации, когда было найдено, что поддержание их связано с негистоновыми белками. В этом случае специфические белки связываются с особыми участками ДНК, которые в местах связывания образуют большие петли или домены. Как уже указывалось, сложная структура ядра или нуклеоида прокариот организована в виде иерархии петлевых доменов ДНК, связанных с небольшим количеством специальных белков.Петлевой принцип упаковки ДНК обнаруживается также и у эукариотических клеток. Так если выделенные ядра обработать 2 М NaCI, т.е. удалить все гистоны, то целостность ядра сохраняется, за исключением того, что вокруг ядра возникнет т.н. «гало», состоящее из огромного числа петель ДНК. Такая структура ядер получила название «нуклеоида». Гало состоит из огромного (до 50000) количества замкнутых на периферии петель ДНК, со средним размером петель около 60 т.п.н., основание которых закреплено где-то внутри ядра, на участках негистоновых белков. Тем самым считается, что после удаления гистонов основания петлевых доменов ДНК, связаны с т.н. «матриксом» или «скэффолдом» - негистоновым белковым остовом интерфазного ядра. Оказалось, что петлевые домены ДНК интерфазных ядер можно выделить. В выделенных ядрах в присутствии двухвалентных катионов (2 мМ Ca++ ) в хроматине ядра выявляются небольшие сгустки величиной около 100 нм, т.н. хромомеры. Если такие хромомеры препаративно выделить, а затем экстрагировать из них гистоны, то под электронным микроскопом можно видеть розетковидные петлистые структуры, где отдельные петли отходят от центрального плотного участка. Количество петель в такой розетке может составлять 15-80, а общая величина ДНК может достигать 200 т.п.н., с суммарной длиной ДНК до 50 мкм. Обработка таких розеток протеиназами приводит к исчезновению плотной центральной области розетки и к разворачиванию петель ДНК.Сходные картины можно наблюдать при разрыхлении политенных хромосом. Здесь хромомеры в виде розеток хроматина выявляются в зонах хроматиновых дисков, в то время как междисковые участки их не содержат. При деконденсации хроматина ядер некоторых растений (Allium, Haemantnus, Vicia), для которых характерна особая структура интерфазных ядер, хромомеры видны в составе хромонемных нитей.Подобные розетковидные петлистые структуры, хромомеры, можно видеть также при разрыхлении и митотических хромосом как животных, так и растений. Следовательно, хромосомные 30 нм фибриллы, состоящие из ДНК и гистонов, упаковываются в виде петлистых розетковидных структур, претерпевая еще дополнительную компактизацию. Это третий уровень структурной организации хроматина, как считается, может приводить уже к 600-кратной компактизации ДНК.Важно отметить, что размер отдельных петлевых доменов совпадает с размером среднихрепликонов и может соответствовать одному или нескольким генам. В своих основаниях петли ДНК связаны негистоновыми белками ядерного матрикса, в состав которых могут входить как ферменты репликации ДНК, так и транскрипции. Такая петельно-доменная структура хроматина обеспечивает не только структурную компактизацию хроматина, но и организует функциональные единицы хромосом - репликоны и транскрибируемые гены. Комплекс белков, участвующих в такой структурно-функциональной организации хроматина, относится к белкам ядерного матрикса. Второй уровень компактизациии - 30 нм фибрилла: Т.о первый, нуклеосомный, уровень компактизации хроматина играет как регуляторную, так и структурную роль, обеспечивая плотность упаковки ДНК приблизительно в 6-7 раз.Однако во многих электронномикроскопических исследованиях было показано, что как в митотических хромосомах, так и в интерфазных ядрах выявляются фибриллы хроматина с диаметром 30 нм. Хроматиновые фибриллы такого диаметра были видны как на ультратонких срезах после фиксации глутаровым альдегидом, так и на препаратах выделенного хроматина и выделенных хромосом в растворах, содержащих хотя бы низкие концентрации двухвалентных катионов. Все это говорило о том, что нуклеосомные цепочки хроматина каким-то специфическим образом уложены так, что возникает не хаотическая агрегация нуклеосом, а правильная нитчатая структура с диаметром 30 нм. Относительно характера упаковки нуклеосом в составе 30 нм фибриллы хроматина существует, по крайней мере, две точки зрения. Одна из них защищает, т.н. соленоидный тип укладки нуклеосом. Согласно этой модели, нить плотно упакованных нуклеосом диаметром 10 нм образует в свою очередь спиральные витки с шагом спирали около 10 нм. На один виток такой суперспирали приходится 6 нуклеосом. В результате такой упаковки возникает фибрилла спирального типа с центральной полостью, которая иногда на негативно окрашенных препаратах бывает видна как узкий «канал» в центре фибриллы. При частичном разворачивании, декомпактизации такой фибриллы и нанесении ее на подложку хорошо видно «зигзагообразное» расположение нуклеосом вдоль фибриллы. Считается, что гистон H1 обеспечивает взаимодействие между соседними нуклеосомами, не только сближая и связывая их друг с другом, но и обеспечивая кооперативную связь нуклеосом так, что образуется довольно плотная спираль из 10 нм фибриллы. Удаление, даже частичное, гистона H1 вызывает переход 30 нм фибриллы в 10 нм фибриллу, а полное удаление его вызывает разворачивание последней в структуру типа «бусин-на-нити». Такой соленоидный тип упаковки ДНК приводит к плотности упаковки равной приблизительно 40 (т.е. на каждый мкм нити приходится 40 мкм ДНК). Эти представления получили подтверждение при анализе структуры хроматина с помощью дифракции рентгеновских лучей и нейтронов. Здесь необходимо отметить, что представление о соленоидном типе укладки получены из анализа вторично конденсированного хроматина. Вначале были получены препараты хроматина в присутствии ЭДТА или выделялись в растворах низкой ионной силы в присутствии ионов магния. Во всех этих случаях первоначально хроматин деконденсировался до уровня «бусин на нити», где отсутствует или дестабилизируется контакт между нуклеосомами. Если же исследовать хроматин в составе ядер или в виде выделенных препаратов, но при поддержании определенной концентрации двухвалентных катионов (не ниже 1мМ), то можно видеть дискретность в составе 30 нм фибрилл хроматина: она состоит как бы из сближенных глобул того же размера, из нуклеомеров. В зарубежной литературе такие 30 нм глобулы или нуклеомеры получили название сверхбусин («супербиды»). Было обнаружено, что если в условиях, когда нуклеомерная структура фибрилл хроматина сохраняется, препараты хроматина подвергнуть нуклеазной обработке, то часть хроматина растворяется. При этом в раствор выходят частицы, имеющие размер около 30 нм с коэффициентом седиментации равным 45S в растворах, содержащих 1 мМ магния. Если такие выделенные нуклеомеры обработать ЭДТА, удалить ионы магния, то они разворачиваются в нуклеосомные цепочки, содержащие 6-8 нуклеосом. Таким образом, в состав одного нуклеомера входит отрезок ДНК, соответствующий 1600 парам оснований или 8 нуклеосомам. Компактность нуклеомера зависит от концентрации ионов магния и наличия гистона. Негистоновые белки в конформационных превращениях нуклеомеров не участвуют. Таким образом основная 30 нм фибрилла хроматина представляет собой линейное чередование нуклеомеров вдоль компактизованной молекулы ДНК. Вероятно, что гистоны H1, находясь в центральной зоне этой крупной частицы, взаимодействуя друг с другом, поддерживают ее целостность. В пользу этого говорят данные о кооперативном связывании гистонов H1 в группе по 6-8 молекул. Противоречие между соленоидной и нуклеомерной моделью упаковки нуклеосом в составе фибрилл хроматина может быть снято, если принять модель нерегулярного соленоида: число нуклеосом на виток спирали не является строго постоянной величиной, что может привести к чередованию участков с большим или меньшим числом нуклеосом на виток. Нуклеомерный уровень укладки хроматина обеспечивает 40 кратное уплотнение ДНК, что важно не только для достижения целей компактизации гигантских молекул ДНК. Компактизация ДНК в составе 30 нм фибрилл хроматина может налагать дополнительные функциональные ограничения. Так было обнаружено, что в составе 30 нм фибриллы хроматина ДНК становится практически недоступной для взаимодействия с таким ферментом как метилаза ДНК. Кроме того резко падает способность хроматина связываться с РНК-полимеразой и рядом регуляторных белков. Таким образом второй уровень компактизации ДНК может играть роль фактора, инактивирующего гены.В заключении необходимо еще раз напомнить, что как нуклеосомный, так и нуклеомерный (супербидный) уровни компактизации ДНК хроматина осуществляются за счет гистоновых белков, которые участвуют не только в образовании нуклеосом, но и в их кооперативном объединении в виде фибрилл ДНП, где ДНК претерпевает дополнительную сверхспирализацию. Все остальные уровни компактизации связаны с дальнейшим характером укладки 30 нм фибрилл в новые компактизационные уровни, где ведущую роль играют негистоновые белки.
В2.--- В3 Паразитизм, как биологический феномен. Специфика среды обитания паразитов. Всякий организм живет в определенной среде, в которой кроме него обитают и другие существа. Любое живое существо находится в тесной зависимости от окружающей среды, к обитанию в которой оно приспособилось в процессе эволюционного формирования соответствующего вида. В отношении факторов питания всех животных можно разделить на три группы: - плотоядных, или животных, которые пожирают другие организмы или даже себе подобных (хищные); - животных, питающихся падалью, разлагающимися органическими веществами (личинки трупной мухи, комнатной мухи, некоторые млекопитающие и птицы); - животных-паразитов, которые питаются за счет соков тканей тела или переваренной пищей живых хозяев. Хищники, нападая на добычу, убивают и пожирают ее. Паразиты же пользуются своими хозяевами многократно в течение всей жизни или жизни своих хозяев. Поэтому паразиты или вовсе не губят своего хозяина, или же не приводят к его смерти в течение продолжительного срока вследствие вызываемого ими заболевания. Паразитизм - это форма сожительства, при которой один организм - паразит живет за счет организма другого вида - хозяина. Паразитизм - это форма сожительства двух генетически разнородных организмов разных видов, при которой один организм (паразит) использует другого (хозяина) как источник питания и среду существования, причиняя ему вред, но, как правило, не уничтожая его. Формы паразитизма чрезвычайно разнообразны. Различают облигатный (постоянно встречающийся, обязательный) и факультативный (возможный, необязательный), временный и постоянный, истинный и ложный, экто- и эндопаразитизм. Паразитизм широко распространен в природе. Он встречается почти во всех типах животного царства. Особенно много паразитов имеется в типах простейших, плоских и круглых червей, членистоногих. Согласно данным В. А. Догеля (1947 г.) в природе около 60-65 тыс. видов являются животными-паразитами. Широкое распространение и разнообразие видов паразитизма позволяет считать, что эта форма сожительства возникла в природе в различных систематических группах животных независимо одна от другой. Билет 69 В1Структура ДНК. Модель Уотсона и Крика. Дезоксирибонуклеи́новая кислота́ (ДНК) — один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетическойпрограммы развития и функционирования живых организмов. Основная роль ДНК в клетках — долговременное хранение информации о структуре РНК и белков. В клетках эукариотов (например, животных или растений) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов. С химической точки зрения, ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков, нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы и фосфатной группы. В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула спирализована. В целом структура молекулы ДНК получила название «двойной спирали». В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином, гуанин — только с цитозином. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции. Кроме того, в геноме эукариот часто встречаются участки, принадлежащие «генетическим паразитам», например, транспозонам. Расшифровка структуры ДНК (1953 г.) стала одним из поворотных моментов в истории биологии. За выдающийся вклад в это открытие Фрэнсису Крику, Джеймсу Уотсону, Морису Уилкинсу была присуждена Нобелевская премия по физиологии и медицине 1962 г. В2.Введение в тератологию. Понятие о критических периодах. ТЕРАТОЛО́ГИЯ [тэратология], тератологии, мн. нет, жен. (греч. teras - чудовище и logos - учение). 1. Наука, изучающая врожденные уродства отдельных органов и целых организмов. 2. Стиль средневекового графического искусства (в орнаменте, заставках, инициалах и т.п.), основанный на нагромождении чудовищно-фантастических образов, то же, что звериный стиль Тератология в древнерусских рукописях. Множество стало рождаться двуликих существ и двугрудых, Твари бычачьей природы с лицом человека являлись, Люди с бычачьими лбами, создание смешанных плодов; Женской породы мужчины, с бесплодными членами твари. (Эмпедокл) В этом четверостишье содержатся указания на рождение сросшихся близнецов, обезображивающие пороки лица и двуполость. В России начало исследований пороков развития человека и животных связано с именем императора Петра I,который в 1718 году издал Указ о создании в Петербурге «Музея уродливостей». Музей был размещён в специальном здании, названом Кунсткамерой. Основу «Музея уродливостей» составляла коллекция анатомических препаратов, в том числе и уродов. В соответствии с Указом Петра I музей стал пополняться редкими препаратами уродств человека и животных. Следует отметить, что первые научные исследования коллекции человеческих уродств в Кунсткамере стали проводиться выдающимися отечественными учёными — академиками К.Бером, К.Вольфом, П.А. Загорским. К этому времени накопились научные сведения по эмбриологии (наука о зародышевом развитии человека), сравнительной анатомии (науки о сравнительном строении тела различных видов животных) и нормальной анатомии (науки о строении тела человека). В ХХ веке были точно установлены причины многих уродств. Так в 1941 году было обнаружено тератогенное действие вируса коревой краснухи, в 1962 году — тератогенное (производящее уродства) действие фармакологического препарата (снотворного) — талидомида. В 70-х годах ХХ столетия была открыта хромосомная (генетическая) природа многих врожденных пороков развития, связанная с наследственной патологией и лишь 3-5 % пороков индуцировано непосредственно тератогенными факторами. В настоящее время в мире успешно работают многочисленные медико-генетические лаборатории, а в ряде ведущих стран - научно-исследовательские тератологические центры. В3 Билет 70. 1. Самовоспроизведениенаследственногоматериала. Одним из основных свойств материала наследственности является его способность к самокопированию - репликация. Это свойство обеспечивается особенностями химической организации молекулы ДНК, состоящей из двух комплементарных цепей. В процессе репликации на каждой полинуклеотидной цепи материнской молекулы ДНК синтезируется комплементарная ей цепь. В итоге из одной двойной спирали ДНК образуются две идентичные двойные спирали. Такой способ удвоения молекул, при котором каждая дочерняя молекула содержит одну материнскую и одну вновь синтезированную цепь, называют полуконсервативным. Для осуществления репликации цепи материнской ДНК должны быть отделены друг от друга, чтобы стать матрицами, на которых будут синтезироваться комплементарные цепи дочерних молекул. Инициация репликации осуществляется в особых участках ДНК, обозначаемых ori (от англ. origin - начало). Они включают последовательность, состоящую из 300 нуклеотидных пар, узнаваемую специфическими белками. Двойная спираль ДНК в этих локусах разделяется на две цепи, при этом, как правило, по обе стороны от точки начала репликации образуются области расхождения полинуклеотидных цепей - репликационные вилки, которые движутся в противоположных от локуса ori направлениях. Между репликационными вилками образуется структура, называемая репликационным глазком, где на двух цепях материнской ДНК образуются новые полинуклеотидные цепи С помощью фермента геликазы, разрывающего водородные связи, двойная спираль ДНК расплетается в точках начала репликации. Образующиеся при этом одинарные цепи ДНК связываются специальными дестабилизирующими белками, которые растягивают остовы цепей, делая их азотистые основания доступными для связывания с комплементарными нуклеотидами, находящимися в нуклеоплазме. На каждой из цепей, образующихся в области репликационной вилки, при участии фермента ДНК-полимеразы осуществляется В процессе синтеза репликационные вилки движутся вдоль материнской спирали в противоположных направлениях, захватывая все новые зоны. Разделение спирально закрученных цепей родительской ДНК ферментом геликазой вызывает появление супервитков перед репликационной вилкой. Это объясняется тем, что при расхождении каждых 10 пар нуклеотидов, образующих один виток спирали, родительская ДНК должна совершить один полный оборот вокруг своей оси. Следовательно, для продвижения репликационной вилки вся молекула ДНК перед ней должна была бы быстро вращаться, что потребовало бы большой затраты энергии. В действительности это не наблюдается благодаря особому классу белков, называемых ДНК-топоизомеразами. Топоизомераза разрывает одну из цепей ДНК, что дает ей возможность вращаться вокруг второй цепи. Это ослабляет накопившееся напряжение в двойной спирали ДНК. К высвобождающимся водородным связям нуклеотидных последовательностей разделенных родительских цепей присоединяются свободные нуклеотиды из нуклеоплазмы, где они присутствуют в виде дезоксирибонуклеозидгрифосфатов: дАТФ, дГТФ, дЦТФ, дТТФ. Комплементарный нуклеозидтрифосфат образует водородные связи с определенным основанием материнской цепи ДНК. Затем при участии фермента ДНК-полимеразы он связывается фосфодиэфирной связью с предшествующим нуклеотидом вновь синтезируемой цепи, отдавая при этом неорганический пирофосфат.Поскольку ДНК-полимераза присоединяет очередной нуклеотид к ОН-группе в 3'-положении предшествующего нуклеотида, цепь постепенно удлиняется на ее 3'-конце.Особенностью ДНК-полимеразы является ее неспособность начать синтез новой полинуклеотидной цепи путем простого связывания двух нуклеозидтрифосфатов: необходим 3'-ОН-конец какой-либо полинуклеотидной цепи, спаренной с матричной цепью ДНК, к которой ДНК-полимераза может лишь добавлять новые нуклеотиды. Такую полинук-леотидную цепь называют затравкой или праймером.Роль затравки для синтеза полинуклеотидных цепей ДНК в ходе репликации выполняют короткие последовательности РНК, образуемые при участии фермента РНК-праймазы (рис.11). Указанная особенность ДНК-полимеразы означает, что матрицей при репликации может служить лишь цепь ДНК, несущая спаренную с ней затравку, которая имеет свободный 3'-ОН-конец. В настоящее время установлено, что синтез второй цепи ДНК осуществляется короткими фрагментами (фрагменты Оказаки) также в направлении от 5' - к 3'-концу (по типу шитья "назад иголкой"). У прокариот фрагменты Оказаки содержат от 1000 до 2000 нуклеотидов, у эукариот они значительно короче (от 100 до 200 нуклеотидов). Синтезу каждого такого фрагмента предшествует образование РНК-затравки длиной около 10 нуклеотидов. Вновь образованный фрагмент с помощью фермента ДНК-лигазы соединяется с предшествующим фрагментом после удаления его РНК-затравки. В связи с указанными особенностями репликационная вилка является асимметричной. Из двух синтезируемых дочерних цепей одна строится непрерывно, ее синтез идет быстрее и эту цепь называют лидирующей. Синтез другой цепи идет медленнее, так как она собирается из отдельных фрагментов, требующих образования, а затем удаления РНК-затравки. Поэтому такую цепь называют запаздывающей (отстающей). Хотя отдельные фрагменты образуются в направлении 5' → 3', в целом эта цепь растет в направлении 3' → 5'. В виду того, что от локуса ori как правило начинаются две репликационные вилки, идущие в противоположных направлениях, синтез лидирующих цепей в них идет на разных цепях материнской ДНК (рис 12, Б). Конечным результатом процесса репликации является образование двух молекул ДНК, нуклеотидная последовательность которых идентична таковой в материнской двойной спирали ДНК. Рассмотренная последовательность событий, происходящих в ходе репликативного синтеза, предполагает участие целой системы ферментов: геликазы, топоизомеразы, дестабилизирующих белков, ДНК-полимеразы и других, совместно действующих в области репликационной вилки (рис 13).Репликация ДНК у про- и эукариот в основных чертах протекает сходно, однако, скорость синтеза у эукариот (около 100 нуклеотидов/с) на порядок ниже, чем у прокариот (1000 нуклеотидов/с). Причиной этого может быть образование ДНК эукариот достаточно прочных соединений с белками, что затрудняет ее деспирализацию, необходимую для осуществления репликативного синтеза. Фрагмент ДНК от точки начала репликации до точки ее окончания образует единицу репликации - репликон. Однажды начавшись в точке начала (локус on), репликация продолжается до тех пор, пока весь репликон не будет дуплицирован. Кольцевые молекулы ДНК прокариотических клеток имеют один локус on и представляют собой целиком отдельные репликоны. Эукариотические хромосомы содержат большое число репликонов. В связи с этим удвоение молекулы ДНК, расположенной вдоль эукариотической хромосомы, начинается в нескольких точках. В разных репликонах удвоение может идти в разное время или одновременно. 2. Периоды онтогенеза человека. Пренатальное и постнатальное развитие. |
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 411. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||