
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Методы кислотно-основного титрованияАцидиметрия -титрование с помощью кислот (титрант -кислота). Алкалиметрия -титрование с помощью щелочей (титрант -щелочь). Ацидиметрически определяют концентрации или массы оснований (KOH, NH4OH) и солей, имеющих вследствие гидролиза щелочную реакцию среды (Na2CO3, NaHCO3); алкалиметричес-ки - концентрации или массы кислот (HCl, H2SO4) и солей, имеющих вследствие гидролиза кислую реакцию среды (NH4Cl). Титранты и их стандартизация Растворы, используемые в кислотно-основном титровании в качестве титрантов, должны отвечать ряду требований: 1) вещество должно быть химически чистым; 2) состав его должен точно соответствовать формуле; 3) вещество должно быть устойчивым при хранении в твердом виде и в растворе; 4) желательно, чтобы вещество имело возможно большую моляр-ную массу. Таким требованиям удовлетворяют: Na2B4O7×10H2O (бура), Na2C2O4, Na2СO3×10H2O, H2C2O4×2H2O и др. Если вещества не удовлетворяют перечисленным выше требованиям (например, HCl, H2SO4, NaOH и др.), то производят их стандартизацию. В ацидиметрии основным титрантом является HCl с С( 1) готовят первичный стандарт из точной навески Na2B4O7×10H2O или Na2СO3×10H2O; 2) проводят реакции между стандартным раствором и раствором HCl: Na2B4O7 + 2HCl + 5H2O = 4H3BO3 + 2NaCl, Na2СO3 + 2HCl = 2NaCl + H2O + CO2; 3) по уравнению (3) рассчитывают точную концентрацию раствора HCl.  В алкалиметрииосновными титрантами являются NaOH и КОН. Их также нельзя приготовить по точной массе (навеске) вещества, так как щелочи взаимодействуют с СО2 и загрязнены примесями К2СО3 и Na2CO3. В данном случае титрант готовят путем разбавления концентрированного (~ 50%) раствора щелочи. Такой способ позволяет избавиться от примесей К2СО3 и Na2CO3, так как они малорастворимы в концентрированных растворах щелочей и удаляются из раствора в виде осадка. После разбавления полученный раствор стандартизуют, используя в качестве первичного стандарта раствор Н2С2О4×2H2O с заданной концентрацией: 2NaOH + Н2С2О4 = Na2C2O4 + 2Н2О, 2КОН + Н2С2О4 = К2С2О4 + 2Н2О. Фиксирование точки эквивалентности При кислотно-основном титровании момент окончания реакции между анализируемым веществом и титрантом обычно не сопровождается внешними признаками, поэтому для его фиксирования необходимо использовать индикаторы. Индикаторы, используемые при кислотно-основном титровании, представляют собой слабые органические кислоты или слабые органические основания, молекулы и ионы которых имеют различную окраску. Индикатор-кислота (условное обозначение HInd) в растворе частично диссоциирует по уравнению: HInd ⇄ H+ + Ind- Индикаторы бывают двуцветными: лакмус (молекулы – красные, ионы – синие), метилоранж (молекулы – красные, ионы – желтые) и одноцветными: фенолфталеин (молекулы – бесцветные, ионы – малиновые). Механизм действия индикаторов В зависимости от концентрации ионов Н+ в растворе диссоциация индикатора происходит в большей или меньшей степени. Так, в растворе сильной кислоты индикатор практически не диссоциирует и находится в молекулярной форме. Таким образом, окраска раствора определяется цветом молекул индикатора. В растворе сильной щелочи индикатор, напротив, диссоциирует практически полностью и находится в растворе в ионной форме. В данном случае окраска раствора определяется цветом ионов индикатора. В остальных случаях индикатор присутствует в растворе как в молекулярной, так и в ионной форме и окраска раствора зависит от соотношения концентраций форм индикатора. |
||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 218. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
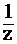 НС1) в интервале от 0,05 до 0,2 моль/л. Приготовить раствор HCl по точной массе исходного вещества весьма затруднительно из-за высокой летучести кислоты, поэтому титрант готовят путем приблизительного разбавления концентрированного раствора HCl с последующей его стандартизацией, которую проводят следующим образом:
НС1) в интервале от 0,05 до 0,2 моль/л. Приготовить раствор HCl по точной массе исходного вещества весьма затруднительно из-за высокой летучести кислоты, поэтому титрант готовят путем приблизительного разбавления концентрированного раствора HCl с последующей его стандартизацией, которую проводят следующим образом: