
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Расчет значений рН и рОН в разбавленных растворах сильных и слабых кислот и основанийЗная концентрацию разбавленных растворов кислот и оснований, можно рассчитывать величины водородного показателя (рН) и гидроксидного показателя (рОН), определяя тем самым активную реакцию среды. 1. В водных растворах сильных кислот (HNO3, HCl, H2SO4 и др.):
или
где С(
В предельно разбавленных водных растворах сильных кислот кажущаяся степень диссоциации
2. В растворах слабых кислот (H2CO3, HCN, СН3СООН и др.):
или
где a - степень диссоциации в долях от единицы;
3. В водных растворах сильных оснований (NaOH, КОН, Са(ОН)2, Sr(OH)2 и др.):
где В предельно разбавленных водных растворах сильных оснований кажущаяся степень диссоциации
4. В растворах слабых оснований (NH3∙H2O):
где |
||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 223. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
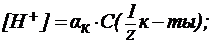

 к-ты) - молярная концентрация эквивалента кислоты (для одноосновных кислот она равна молярной концентрации кислоты);
к-ты) - молярная концентрация эквивалента кислоты (для одноосновных кислот она равна молярной концентрации кислоты); - кажущаяся степень диссоциации (в долях от единицы).
- кажущаяся степень диссоциации (в долях от единицы).



 - константа диссоциации кислоты (для многоосновных кислот, учитывают диссоциацию только по первой ступени);
- константа диссоциации кислоты (для многоосновных кислот, учитывают диссоциацию только по первой ступени); , pa и рС(
, pa и рС( 
 С(
С(  » 1, поэтому [ОН-] практически равняется общей концентрации растворов этих щелочей:
» 1, поэтому [ОН-] практически равняется общей концентрации растворов этих щелочей:

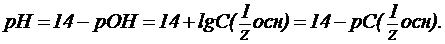
 ;
;
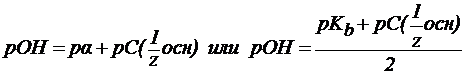

 ‑ константа диссоциации основания.
‑ константа диссоциации основания.