
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Титрование сильной кислоты сильным основанием.Общий вид кривой титрования представлен на рис. 1*. Видно, что точке эквивалентности соответствует значение рН = 7, а скачок рН находится в интервале от 4 до 10, т.е. включает в себя кислую, нейтральную и щелочную области. * Для всех случаев приведены приближенные интервалы скачков рН, имеющих место при концентрациях кислот и щелочей, равных 0,1 моль/л. Таким образом, для фиксирования точки эквивалентности могут быть использованы индикаторы, интервал перехода окраски которых находится в области значений рН от 4 до 10. Этому критерию отвечают, например, метиловый оранжевый (
Рис. 1. Кривая титрования сильной кислоты (НС1) сильным основанием (KOH). С( 2. Титрование слабой кислоты сильным основанием. Рассмотрим в качестве примера кривую титрования уксусной кислоты раствором KOH (рис. 2). Видно, что точке эквивалентности соответствует значение рН = 9, а скачок рН находится в интервале от 8 до 10, т.е. в щелочной среде. Это объясняется тем, что в результате реакции образуется ацетат калия, раствор которого вследствие гидролиза имеет щелочную реакцию среды: CH3COOH + KOH ⇄ CH3COOK + H2O Таким образом, для фиксирования точки эквивалентности могут быть использованы индикаторы, интервалы перехода окраски которых совпадают с областью скачка значений рН. Такому условию отвечают, например, фенолфталеин (  Аналогичный вид имеют и кривые титрования растворов солей, имеющих кислую реакцию среды (например, NH4Cl) сильными основаниями. Титрование слабого основания сильной кислотой. При титровании водного раствора аммиака раствором HCl точке эквивалентности соответствует значение рН = 5, а скачок рН находится в интервале от 4 до 6, т.е. в кислой среде (рис. 3). Это объясняется тем, что в результате реакции образуется хлорид аммония, раствор которого вследствие гидролиза имеет кислую реакцию среды: NH3×H2O + HCl ⇄ NH4Cl + H2O Здесь для фиксирования точки эквивалентности пригодны индикаторы, меняющие окраску в области значений рН от 4 до 6. В частности, может быть использован метилоранж ( Аналогичный вид имеют и кривые титрования растворов солей, имеющих щелочную реакцию среды (например, Na2CO3) сильными кислотами.
Рис. 2. Кривая титрования слабой кислоты (CН3COOH) сильным основанием (KOH). С(
Рис. 3. Кривая титрования слабого основания (NH3×H2O) сильной кислотой (HCl). С(
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ ОКСИДИМЕТРИЯ |
||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 267. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 = 4, интервал перехода окраски при рН от 3,1 до 4,4) и фенолфталеин (
= 4, интервал перехода окраски при рН от 3,1 до 4,4) и фенолфталеин ( 
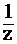 НС1) = 0,1 моль/л, С(
НС1) = 0,1 моль/л, С( 
