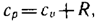Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Полная энергия тела(системы), внут энергия,энтальпия, энтропия, свойстваПолная энергия системы является суммой внешней и внутренней энергии системы. Внешняя энергия системы состоит из кинетической и потенциальной энергий системы как целого. Внутренняя энергия системы – это энергия системы, зависящая только от ее внутреннего состояния и не включающая в себя виды энергии системы как целого. Внутреннюю энергию системы U можно, в частности, найти, измеряя работу системы в адиабатном процессе (то есть при Q = 0): Аад = — U, что определяет U с точностью до некоторой аддитивной постоянной U0: U = U + U0 Первое начало термодинамики утверждает, что U является функцией состояния системы, то есть каждое состояние термодинамической системы характеризуется определённым значением U, независимо от того, каким путём система приведена в данное состояние (в то время как значения Q и А зависят от процесса, приведшего к изменению состояния системы). При исследовании термодинамических свойств физической системы первое начало термодинамики обычно применяется совместно со вторым началом термодинамики. В современной термодинамике второе начало термодинамики изолированных систем формулируется единым и самым общим образом как закон возрастания особой функции состояния системы, которую Клаузиус назвал энтропией (S). Физический смысл энтропии состоит в том, что в случае, когда материальная система находится в полном термодинамическом равновесии, элементарные частицы, из которых состоит эта система, находятся в неуправляемом состоянии и совершают различные случайные хаотические движения. В принципе можно определить общее число этих всевозможных состояний. Параметр, который характеризует общее число этих состояний, и есть энтропия. Q/Т=дельтаS [Дж/К]. S=0 для идеального цикла. S>>0 для реального цикла! Изменение энтропии – отношение теплоты отданной или полученной в изотермическом процессе  В термодинамике важную роль игра- ет сумма внутренней энергии системы U и произведения давления системы р на ее объем V, называемая энтальпией и обозначаемая Н: H=U + pV. Так как входящие в нее величины явля- ются функциями состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, ра- бота и теплота, она измеряется в джоу- лях (| Энтальпия обладает свойством адди- тивности. ^Величина h= u+pv, называемая удельной энталь- пией (h = H/M), представляет собой энтальпию системы, содержащей 1 кг ве- щества, и измеряется в Дж/kг Изменение энтальпии в любом про- цессе определяется только начальным и конечным состояниями тела и не за- висит от характера процесса. 10 выражение теплоты и работы через т/д параметры Внутренняя энергия системы, как было отмечено выше, изменяется в результате взаимодействия системы с внешней средой. Это взаимодействие может быть двояким. Первый способ передачи энергии (обмен энергии в виде тепла) реализуется при непосредственном контакте тел, имеющих различную температуру, путём обмена кинетической энергией между молекулами соприкасающихся тел. При этом энергия передаётся от более нагретого тела к менее нагретому, т.е. от тела, имеющего большую среднюю кинетическую энергию молекул, к телу с меньшей кинетической энергией молекул. Поскольку передача энергии этим способом происходит на молекулярном уровне, без видимого движения тел, то её называют микрофизической формой передачи энергии. Количество энергии, переданной первым способом от одного тела к другому, называют количеством теплоты, или просто теплотой. Теплота, также, как любая энергия, измеряется в Джоулях (Дж). Принято обозначать произвольное количество теплоты черезQ, а удельное (отнесённое к 1 кг) -через q. Подведённая теплота считается положительной, а отведённая - отрицательной. Второй способ передачи энергии связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объём под действием внешнего давления. Иначе говоря, в этом случае передача энергии происходит при условии перемещения всего тела или его части в пространстве. Поэтому второй способ будет макроскопической формой передачи энергии. Этот способ называется передачей энергии в форме работы, а количество переданной энергии в процессе - работой. Работа также измеряется в Джоулях. Произвольное количество энергии, переданное в форме работы, обозначают через L, а удельное - l. В общем случае передача энергии в форме теплоты и в форме работы может происходить одновременно. При этом важно отметить, что в различных термодинамических процессах, в зависимости от условий их протекания, количество теплоты и работы будет также различно. Следовательно, теплота и работа являются функциями процесса. Математическая запись → l процесс - 1g2; потом изобарный – 1е2. Работа «+», если тело розширяется l > 0, dV>0(V2 > V1). Работа «-», если dV<0, (V2 < V1 ).
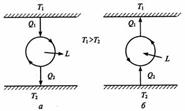
lц >0, если прямые цыклы. lц <0, если обратные цыклы. Теплота dS= q > 0, если dS>0 (S2 > S1). q < 0, если dS<0 (S2 < S1). qц = 0. qц > 0, если прямые цыклы qц < 0, если обратные цыклы. Второе нач термодинамики Второе начало термодинамикиявляется законом, в соответствии с которым макроскопические процессы, протекающие с конечной скоростью, необратимы. В отличие от идеальных (без потерь) механических или электродинамических обратимых процессов, реальные процессы, связанные с теплообменом при конечной разности температур (т. е. текущие с конечной скоростью), сопровождаются разнообразными потерями: на трение, диффузию газов, расширением газов в пустоту, выделением джоулевой теплоты и т.д. Поэтому эти процессы необратимы, то есть могут самопроизвольно протекать только в одном направлении. Само название «Второе начало термодинамики» и первая его формулировка (1850 г.) принадлежат Р. Клаузиусу: «…невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более нагретым». Причем такой процесс невозможен в принципе: ни путем прямого перехода теплоты от более холодных тел к более теплым, ни с помощью каких–либо устройств без использования каких-либо других процессов. В 1851 году английский физик У. Томсон дал другую формулировку второго начала термодинамики: «В природе невозможны процессы, единственным следствием которых был бы подъем груза, произведенный за счет охлаждения теплового резервуара». Как видно, обе приведённые формулировки второго начала термодинамики практически одинаковы. Отсюда следует невозможность реализации двигателя 2-го рода, т.е. двигателя без потерь энергии на трение и другие сопутствующие потери. Кроме того, отсюда также следует, что все реальные процессы, происходящие в материальном мире в открытых системах, необратимы.В современной термодинамике второе начало термодинамики изолированных систем формулируется единым и самым общим образом как закон возрастания особой функции состояния системы, которую Клаузиус назвал энтропией (S). Физический смысл энтропии состоит в том, что в случае, когда материальная система находится в полном термодинамическом равновесии, элементарные частицы, из которых состоит эта система, находятся в неуправляемом состоянии и совершают различные случайные хаотические движения. В принципе можно определить общее число этих всевозможных состояний. Параметр, который характеризует общее число этих состояний, и есть энтропия. dSнеобр = (δq + δqтр )/Т, где δq - уд. внешн. теплота в процессе. dSнеобр > δq / Т. – принцип возростания энтропии. .Пусть изолированная система состоит из двух тел «1» и «2», обладающих неодинаковой температурой T1 > T2. Тело «1» отдает некоторое количество тепла Q , а тело «2» его получает. При этом идет тепловой поток от тела «1» к телу «2». По мере уравнивания температур увеличивается суммарное количество элементарных частиц тел «1» и «2», находящихся в тепловом равновесии.По мере увеличения этого количества частиц увеличивается и энтропия. И как только наступит полное тепловое равновесие тел «1» и «2», энтропия достигнет своего максимального значения. Таким образом, в замкнутой системе энтропия S при любом реальном процессе либо возрастает, либо остаётся неизменной, т. е. изменение энтропии S 0. Знак равенства в этой формуле имеет место только для обратимых процессов. В состоянии равновесия, когда энтропия замкнутой системы достигает максимума, никакие макроскопические процессы в такой системе, согласно второму началу термодинамики, невозможны. Отсюда следует, что энтропия - физическая величина, количественно характеризующая особенности молекулярного строения системы, от которых зависят энергетические преобразования в ней. Связь энтропии с молекулярным строением системы первым объяснил Л. Больцман в 1887 году. Он установил статистический смысл энтропии (формула 1.6). Согласно Больцману (высокая упорядоченность имеет относительно низкую вероятность) S = k lnP, где k — постоянная Больцмана, P – статистический вес. k = 1.37·10-23 Дж/К. Для изолированной системы термодинамическая вероятность W данного макросостояния пропорциональна его статистическому весу и определяется энтропией системы: W exp (S/k). Таким образом, закон возрастания энтропии имеет статистически-вероятностный характер и выражает постоянную тенденцию системы к переходу в более вероятное состояние. Отсюда следует, что наиболее вероятным состоянием, достижимым для системы, является такое, в котором события, происходящие в системе одновременно, статистически взаимно компенсируются. Максимально вероятным состоянием макросистемы является состояние равновесия, которого она может в принципе достичь за достаточно большой промежуток времени. Как было указано выше, энтропия является величиной аддитивной, то есть она пропорциональна числу частиц в системе. 12 условия работы тепловых машин. Прямые и обратные циклы. Термодинамич КПД и холодильный коэф Машины, производящие механическую работу в результате обмена теплотой с окружающими телами, называются тепловыми двигателями. В большинстве таких машин нагревание получается при сгорании топлива, благодаря чему нагреватель получает достаточно высокую температуру. В этих случаях работа совершается за счет использования внутренней энергии смеси топлива с кислородом воздуха. Кроме того, существуют машины, в которых нагревание производится Солнцем, а также проекты машин, использующих разности температур морской воды. Однако пока ни те, ни другие не имеют заметного практического значения. В настоящее время эксплуатируются также тепловые машины, использующие теплоту, выделяющуюся в реакторе, где происходит расщепление и преобразование атомных ядер Термодинамическим циклом (или круговым процессом) называют процесс, при котором термодинамическая система, выйдя из первоначального состояния по завершении цикла, вновь возвращается в это же состояние. Различают прямые и обратные циклы (рис. 1.1).
Рис. 1.1. Прямой (а) и обратный (б) термодинамические циклы
В прямом цикле теплота передается от тела с более высокого температурного уровня к телу с более низкой температурой, а термодинамическая система, выполняющая роль посредника, превращает часть передаваемой теплоты в работу. Для того, чтобы управлять состоянием рабочего тела, в тепловую машину входят нагреватель и холодильник. В каждом цикле рабочее тело забирает некоторое количество теплоты (Q1) у нагревателя и отдаёт количество теплоты Q2 холодильнику. Работа, совершённая тепловой машиной в цикле, равна, таким образом,
так как изменение внутренней энергии U в круговом процессе равно нулю (это функция состояния). Напомним, что работа не является функцией состояния, иначе суммарная работа за цикл также была бы равна нулю. При этом нагреватель потратил энергию Q1. Поэтому тепловой, или, как его ещё называют, термический или термодинамический коэффициент полезного действия тепловой машины (отношение полезной работы к затраченной тепловой энергии) равен
Холодильный коэффициент,безразмерная величина (обычно больше единицы), характеризующая энергетическую эффективность работы холодильной машины; равна отношению холодопроизводительности к количеству энергии (работе), затраченной в единицу времени на осуществление холодильного цикла. Определяется типом холодильного цикла, по котором у работает машина, совершенством ее основных элементов и для одной и той же машины зависит от температурных условий ее работы. Различают теоретический и реальный Холодильный коэффициент В частности, теоретический Холодильный коэффициент идеальной парокомпрессионной машины, работающей по обратному Карно циклу, не зависит от рода холодильного агента и определяется выражением eк = T0/(Т - Т0), где T0 и Т - абсолютные температуры охлаждаемого объекта и окружающей среды (кипения и конденсации хладагента)
Цикл Карно и его свойства
Пусть тепловая машина состоит из нагревателя с температурой TH, холодильника с температурой TX и рабочего тела. Цикл Карно состоит из четырёх стадий:
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия (поскольку Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении, при этом энтропия адиабатически изолированной (без теплообмена с окружающей средой) системы не меняется. 14термодинамические процессы. Классиф общие методы исслед-я Термодинамические процессы, в которых не происходят изменения агрегатного состояния рабочего тела или его природы в результате протекания химической реакции, можно назвать простыми процессами, а конечное равновесное состояние, к которому приходит термодинамическая система, в этом случае является статическим со стоянием равновесия. Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым. . Поскольку всегда имеет место рассеяние энергии ( например, за счет трения), то любой реальный процесс необратим. Термодинамические процессы, в результате которых рабочее тело ( газы, получаемые при сгорании топлива в цилиндрах), проходя последовательно различные состояния, возвращается снова в первоначальное ( исходное) состояние, называются замкнутыми процессами, или циклами.
15Т/д процессы идеал газов. Уравнение политропы Изохорный
Изобарный
Изотермический
Адиабатный
|
||
|
Последнее изменение этой страницы: 2018-05-27; просмотров: 233. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 . Если
. Если  =
= 
 - удельная работа. Сначало изохорный
- удельная работа. Сначало изохорный → δq=TdS. Матем. запись q
→ δq=TdS. Матем. запись q  .
.
 ,
,



 при δQ = 0).
при δQ = 0).










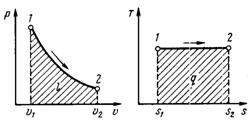
 l= RT ln(V2/V1)= RT ln(p1/p2)
l= RT ln(V2/V1)= RT ln(p1/p2) s2-s1=R ln(p1/p2)=R ln(V2/V1)
s2-s1=R ln(p1/p2)=R ln(V2/V1)
 K=1+R/Cv
K=1+R/Cv