Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
N-аминобензолсульфацетамид натрияВ медицине применяют 10%; 20% и 30% растворы сульфацил-натрия. Состав глазных капель: Сульфацил-натрия 3,0 Натрия тиосульфата 0,015 Раствора кислоты хлористоводородной 1 М - 0,035 мл Воды очищенной стерильной до 10 мл Объем общ. 10 мл №30
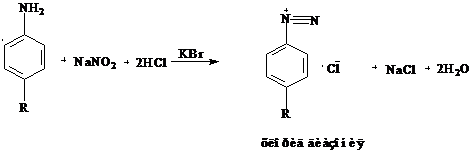
Свойства Бесцветный прозрачный раствор без видимых механических включений Подлинность I Сульфауил-натрии На амногруппу а) Реакция диазотирования с последующим азосочетанием. К 2-3 каплям раствора прибавляют 5-6 капель разведенной хлористоводородной кислоты, 2-3 капли 0.1 моль/ раствора нитрита натрия. 3-6 капель полученного раствора приливают к 1-2 мл щелочного раствора β-нафтола. Появляется вишнево-красное окрашивание.
б) Лигниновая проба 1 каплю раствора выносят на простую бумажную капсулу и прибавляют 2 капли разведенной хлористоводородной кислоты. Появляется оранжевое окрашивание.
На сульфамидную группу. К 2-3 каплям раствора прибавляют 2-3 капли раствора сульфата меди. Образуется голубовато-зеленый осадок, который не изменяется при стоянии.
2. натрия тиосульфат К 1 мл раствора прибавляют 3-4 капли 0,1 моль/л раствора йода. Наблюдается обесцвечивание раствора йода.
2 Na2S2O3 + I2 = 2 NaI + Na2S4O6
Количественное определение 1.Количественное определение суьфацил-натрия. а)Рефрактометрический метод
F – см. рефрактометрические таблицы.
б) Титриметрические методы количественного определения. Мл раствора помещают в мерную колбу на 50 мл и объём водой доводят до метки.
Метод нитритометрии 1 мл приготовленного разведения помещают в склянку для титрования, прибавляют 1 мл раствора разведенной хлористоводородной кислоты, 5 мл воды, 0,2г калия бромида, 2 капли индикатора тропеолин ОО и 1 каплю метиленового синего и титруют при температуре 8-100С 0,1 моль/л раствором нитрита натрия со скоростью 0,1-0,2 мл в минуту в начале титрования и 1 каплв минуту в конце титрования до перехода фиолетовой окраски раствора в голубую. 
1 мл 0,1 моль/л раствора нитрита натрия соответствует 0,02542г. сульфацила натрия.
Допустимые отклонения ? V ориент ?
б) Метод нейтрализации 1 мл приготовленного разведения помещают в склянку для титрования, прибавляют 2 капли метилового оранжевого и 1 каплю метиленового синего. Титруют 0,1 моль/л раствором хлористоводородной кислоты до перехода зелёной окраски раствор в фиолетовую. 1 мл 0,1 моль/л раствора хлористоводородной кислоты соответствует 0,02542г. сульфацила натрия.
Кошличественное определение тиосульфата натрия. К 5 мл раствора прибавляют 5 капель крахмала и титруют 0,02 моль/л раствором йода до синей окраски раствора. 1 мл 0,02 моль/л раствора йода соответствует 0,004964 г тиосульфата натрия
2 Na2S2O3 + I2 = 2 NaI + Na2S4O6
Допустимые отклонения ? V ориент ?
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 263. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |