
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Различные модификации уравнений массоотдачи и массопередачи.Стр 1 из 7Следующая ⇒ Массообменные Процессы и аппараты МАССООБМЕН. Лекция 7 Фазовые равновесия.
Основная задача химико-технологического процесса состоит в направленном изменении макроскопических свойств участвующих в процессе веществ: состава, агрегатного состояния, давления P и температуры Т. При этом происходит перенос субстанций: массы, энергии, импульса. Предельное состояние системы – подвижное равновесие, при котором не происходит изменений макроскопических свойств веществ. Равновесным называют такое состояние системы, при котором перенос субстанций отсутствует. В изолированной системе условия равновесия определяется только внутренними условиями и записываются так:
Здесь, Условия (1.1) называют условиями механического, термического и химического равновесия. Все самопроизвольные процессы сопровождаются увеличением энтропии системы. В состоянии равновесия энтропия достигает максимального значения:
Таким образом, условия равновесия системы определяются уравнениями (1.1) и (1.2). Для открытой системы равновесное состояние может быть устойчивым лишь при её равновесии с окружающей средой.
Движущая сила процессов переноса возникает вследствие отклонения от равновесия в самой системе или в окружающей среде. Все технологические схемы является открытыми системами. Химический потенциал  Химический потенциал компонента непосредственно изменить невозможно. Для его расчета используют соотношения между термодинамическими функциями, которые, в свою очередь, зависят от состава смеси. Поэтому в инженерных расчетах для определения движущей силы процесса используют разность концентраций. Правило фаз Гиббса определяет возможность существования фаз, но не указывает на количественных зависимостей переноса вещества между фазами.
Здесь С – число степеней свободы (Р,Т и концентрация) – минимальное число параметров, которые можно изменять независимо друг от друга, не нарушая равновесие данной системы; Для процессов переноса массы
Обычно зависимости между параметрами строят в плоских координатах. Такие диаграммы называются фазовыми. Для бинарной смеси строят следующие фазовые диаграммы:
Рис.1.1. Схема массообменного процесса.
Рассмотрим пример поглощения аммиака чистой водой из аммиачно-воздушной смеси: у - концентрация аммиака в воздухе, х - концентрация аммиака в воде. Аммиак - распределяемый компонент (абсорбтив). С началом растворения аммиака в воде начнётся переход части его молекул со скоростью, пропорциональной концентрации аммиака в воде. С течением времени скорость переноса аммиака в воду будет снижаться, а скорость обратного переноса возрастать. Такой двусторонний перенос будет продолжаться до установления динамического равновесия – когда переходы в обоих направлениях будут равны. При равновесии достигается определённая зависимость между равновесными концентрациями распределяемого вещества в фазах при Т и
где у* - равновесная концентрация аммиака в воздухе, при концентрации аммиака в воде х. Графическое изображение зависимости (1.4) и есть линия равновесия. Эту зависимость представим в виде:
у* = mx (1.5)
где m – коэффициент распределения. Для двухкомпонентной двухфазной системы коэффициент распределения будет зависеть от двух переменных m=f(T,x)=f(
Следовательно, необходимо иметь набор экспериментальных данных по равновесию по всей области изменения двух параметров. При увеличении числа компонентов в системе ситуация ещё более усложняется. При отсутствии таких экспериментальных данных для определения коэффициента распределения можно использовать аналитические зависимости. Такие зависимости рассмотрены у А.И. Разинова и В.Б. Когана. Конкретный вид равновесия (1.5) различен для разных процессов массообмена. Например, для абсорбции равновесие описывается законом Генри, для ректификации – законом Рауля и т.д. Зная линию равновесия и рабочую линию для конкретного процесса можно определить направление и движущую силу массообмена в любой точке аппарата.
Материальный баланс. В стационарных условиях закон сохранения массы для всего аппарата в виде материального баланса может быть представлен:
Материальный баланс по распределённому компоненту при отсутствии химических реакций имеет вид:
В случае постоянства расходов
Для элементарного участка аппарата имеем: – Знак минус свидетельствует о противоположном изменении концентрации распределяемого компонента в фазах, если в одной фазе увеличивается, то в другой – наоборот, уменьшается.
1.3 Уравнения рабочих и равновесных линий.
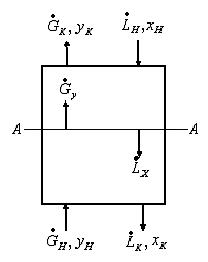
Предположим, что перенос распределяемого компонента происходит из фазы
Рис.1.2. Схема массообменного процесса в противоточном аппарате.
Из уравнения материального баланса можно получить уравнение рабочей линии. Уравнение материального баланса для нижней части аппарата до сечения А-А:
поступает расходуется Находим из (1.10) у:
В случае постоянства расходов
Полученное уравнение (1.11) является уравнением рабочей линии и представляет собой уравнение прямой линии. Аналогичным образом может быть получено уравнение рабочей линии для прямоточного аппарата.
Рис.1.3. Схема массообменного процесса в прямоточном аппарате
поступает расходуется
Находим из (1.12) у:
а б
Рис.1.4. Рабочие линии: а – противоток, б – прямоток.
Запишем уравнение равновесной линии, связывающее рабочую концентрацию распределяемого компонента в одной из фаз с его равновесной концентрацией в другой фазе. Под равновесной концентрацией в произвольном сечении аппарата понимают концентрацию компонента в фазе, находящейся в равновесии с другой, состав которой определяется рабочей концентрацией. Уравнение равновесной линии:
у*=mх (1.14)
Здесь у* - равновесная концентрация в фазе G, х – рабочая концентрация в фазе L, m – коэффициент распределения.
Рис.1.5. Рабочие (1 и 2) и равновесная (3) линии.
Рабочая концентрация распределяемого компонента в фазе G превышает равновесную. Поэтому распределяемый компонент будет переходить из G фазы во вторую фазу L, до равновесия т.к. Различные модификации уравнений массоотдачи и массопередачи. Ранее было получено уравнение массопередачи, движущей силой, в которой являлась разница химических потенциалов компонента в ядрах различных фаз. 1.Расчёт химических потенциалов, как известно, задача сложная. Поэтому на практике обычно пользуются уравнениями массотдачи и массопередачи, содержащими в качестве движущей силы разность концентраций компонента. 2.При использовании интегральной формы уравнений массотдачи и массопередачи большой проблемой является определение поверхности контакта фаз в реальном аппарате, т.к. она может складываться из поверхности струй, капель, пузырей, пены. В этом случае применяют модифицированные уравнения, не содержащие величину межфазной поверхности.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 217. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 ,
, 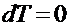 ,
,  (1.1)
(1.1) – химический потенциал
– химический потенциал 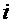 -того компонента.
-того компонента. (1.2)
(1.2) (1.3)
(1.3) – число фаз системы;
– число фаз системы;  – число независимых компонентов системы;
– число независимых компонентов системы;  – число внешних факторов, влияющих на положение равновесия в данной системе.
– число внешних факторов, влияющих на положение равновесия в данной системе. =2 ( давление и температура).
=2 ( давление и температура).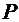 –
–  при Т=const, Т–
при Т=const, Т– 
 , (1.4)
, (1.4) (1.6)
(1.6)
 ,
,  – соответственно, расходы жидкой и газовой фаз; х, у – концентрация распределяемого компонента в фазах; н – начальное, к – конечное состояние.
– соответственно, расходы жидкой и газовой фаз; х, у – концентрация распределяемого компонента в фазах; н – начальное, к – конечное состояние. (1.7)
(1.7) и
и  уравнение (1.7) упрощается:
уравнение (1.7) упрощается: (1.8)
(1.8) в фазу
в фазу  .
.
 (1.10)
(1.10)
 (1.11)
(1.11)
 (1.12)
(1.12) , если расходы не меняются, т.е.
, если расходы не меняются, т.е.  (1.13)
(1.13)

 .
.