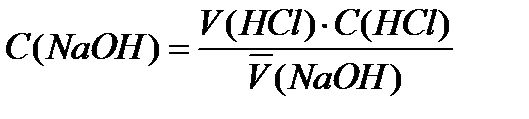Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение концентрации (активности) фторид-ионов при помощи ионоселективного электрода методом прямой потенциометрии
Для измерения концентрации ионов используют гальванический элемент, составленный из ионоселективного индикаторного электрода и хлоридсеребряного электрода сравнения.
Оборудование и реактивы
рН-Метр (иономер), фторидселективныйэлектрод, электрод сравнения (хлоридсеребряный), магнитная мешалка с якорем, раствор KNO3 (С=1 М), стандартный раствор фторид-ионов (С=0,1000 М), насыщенный раствор хлорида калия, фильтровальная бумага, стакан вместимостью 100-150 см3, мерные пипетки, мерные колбы вместимостью 100,0 см3, анализируемый раствор фторид-ионов.
Ход работы
Построение калибровочного графика
В колбах вместимостью 100,0 см3 готовят последовательным разбавлением серию растворов с концентрацией от 10-2 до 10-6 Мфторид-ионовиз стандартного раствора фторид-ионов с концентрацией 0,1000 М, создавая в каждой колбе постоянную (0,1 М) концентрацию БРОИС (Буферный Раствор Общей Ионной Силы). При определении концентрации фторид-ионов в качестве БРОИС используют 1 М раствор нитрата калия. Для приготовления серии стандартных растворов в колбу № 1 пипеткой вносят 10,00 см30,1 М раствора фторид-иона, добавляют 10,00 см3 БРОИС (1 М), разбавляют до метки дистиллированной водой и тщательно перемешивают. В колбу № 2 пипеткой вносят из колбы № 1 10,00 см3 раствора, добавляют 10,00 см3 БРОИС, разбавляют до метки дистиллированной водой и тщательно перемешивают и т.д. Затем измеряют ЭДС каждого раствора, переходя от меньшей концентрации к большей, наливая раствор в стакан вместимостью 100-150 см3, предварительно ополоснув его (измерения ЭДС проводят при перемешивании раствора с помощью магнитной мешалки). Величину ЭДС фиксируют после установления равновесного значения (в разбавленных растворах время отклика ионселективного электрода возрастает и для концентрации 10-6 М составляет 2-3 минуты). Между измерениями ЭДС электроды вынимают из раствора и осторожно удаляют с боковой поверхности электродов и мембраны ИСЭ избыток влаги фильтровальной бумагой.  Результаты измерений заносят в таблицу.
Строят калибровочный график в координатах Е=f(pF) и находят область прямолинейной зависимости. Определяют крутизну электродной функции S (мВ), как тангенс угла наклона прямой и сравнивают с теоретическим значением (Sтеор.=59 мВ).
Определение концентрации (активности) фторид-ионов По калибровочному графику
В мерную колбу вместимостью 100,0 см3 пипеткой вносят аликвоту анализируемого раствора фторид-иона, добавляют 10,00 см3 БРОИС, разбавляют до метки дистиллированной водой и тщательно перемешивают. Наливают приготовленный раствор в сухой и чистый стакан вместимостью 100-150 см3, измеряют ЭДС и по градуировочному графику находят концентрацию ионов в анализируемом растворе.
Контрольные вопросы
1. Сущность метода прямой потенциометрии. Электроды, применяемые в методах прямой потенциометрии. 2. Способы определения концентрации ионов в методе прямой потенциометрии.
Стандартизация раствора гидроксида натрия по титрованному раствору соляной кислоты методом потенциометрического титрования
Потенциометрическое титрование основано на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым компонентом и титрантом. В зависимости от типа используемой реакции различают несколько методов потенциометрического титрования: кислотно-основное, окислительно-восстановительное (редокс-), осадительное, комплексо- и комплексонометрическое. Конечную точку титрования (КТТ) находят по скачку потенциала, отвечающему моменту завершения реакции. 1) Точка перегиба на интегральной кривой титрования отвечает КТТ, которая может совпадать или не совпадать с точкой эквивалентности. Для нахождения точки перегиба проводят две параллельные касательные к пологим верхней и нижней частям кривой и соединяют их прямой таким образом, чтобы точка пересечения ее с кривой титрования делила эту прямую на две равные части (точка А на рис. 1-а). Точка пересечения перпендикуляра, опущенного из точки А с осью абсцисс (осью V – объем титранта) дает объем титранта, отвечающий КТТ. 2) Более простым и точным способом нахождения КТТ является графическое изображение зависимости величин первой производной ΔЕ/ΔV от объема прибавленного титранта (дифференциальная кривая титрования). В этом случае кривая имеет пикообразную форму, максимум которой соответствует КТТ. Перпендикуляр, опущенный из точки пересечения двух восходящих ветвей кривой на ось абсцисс, показывает объем титранта, затраченный на завершение реакции (рис. 1-б). Расчет концентрации анализируемого вещества в потенциометрическом титровании проводится аналогично расчетам в обычном титриметрическом анализе. Достоинствами потенциометрического титрования являются высокая точность и воспроизводимость определений, особенно при титровании разбавленных растворов. Потенциометрическое титрование можно проводить в мутных и окрашенных растворах, а также анализировать смеси близких по свойствам кислот и оснований, окислителей и восстановителей без предварительного разделения. Потенциометрическое титрование требует большей затраты времени, чем обычное титрование с цветным индикатором. Поэтому данный метод применяют обычно в тех случаях, когда визуальное фиксирование точки конца титрования затруднено.
Рис. 1. Графический способ нахождения конечной точки титрования (к.т.т.): а – интегральная кривая, б – дифференциальная кривая
Оборудование и реактивы
рН-Метр (иономер), стеклянный электрод, хлоридсеребряный электрод, магнитная мешалка с якорем, бюретка вместимостью 25,00 см3, стакан вместимостью 100-150 см3, раствор гидроксида натрия (С~0,1 н.), стандартный раствор соляной кислоты (С=0,1000 н.).
Ход работы
Точную концентрацию раствора гидроксида натрия устанавливают потенциометрическим титрованием аликвоты стандартного раствора соляной кислоты. Для этого в ячейку для титрования (стакан) вносят пипеткой 10,00 см3 0,1000 н. раствора соляной кислоты, разбавляют водой, опускают электроды (стеклянный и хлоридсеребряный), включают мешалку и проводят титрование ~0,1 М раствором гидроксида натрия, прибавляя раствор титранта порциями по 0,5 см3 (в области скачка титрования – по 0,1 см3) и измеряя рН раствора. Таким образом, проводят два титрования. Результаты потенциометрического титрования заносят в таблицу.
Титрант – раствор гидроксида натрия, установочное вещество – соляная кислота (указывают точную молярную концентрацию эквивалента). Строят графики зависимости рН от объема раствора гидроксида натрия (кривые титрования – интегральную и дифференциальную). Определяют объемы раствора гидроксида натрия, пошедшие на титрование (Vт.э.(NaOH)1-2,3-4), вычисляют средний объем и рассчитывают молярную концентрацию эквивалента раствора гидроксида натрия (моль/дм3 эквивалента) по формуле:
Контрольные вопросы
1. Сущность метода потенциометрического титрования. Определяемые вещества и рабочие растворы. Кривые титрования. Методы расчета конечной точки титрования. 2. Электроды, используемые в потенциометрическом титровании. Строение и принцип действия электродов.
Лабораторная работа № 5 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 653. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |