Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Качественные реакции на мыло⇐ ПредыдущаяСтр 12 из 12 1. Выделение свободных высших жирных кислот. Около 1 г мыла растворяют в 8-10 см3 воды при нагревании. К полученному раствору прибавляют
2. Действие солей мгоговалентных металлов. К 3 см3 0,5%-го раствора мыла прибавляют несколько капель 10%-го раствора хлористого кальция. Наблюдают образование осадка нерастворимых кальциевых солей высших жирных кислот.
G Техника безопасности.При омылении жира используют достаточно концентрированные растворы едкого натра, которые при попадании на кожу или слизистые оболочки могут вызвать сильное раздражение и даже химические ожоги. В этом случае места поражения следует промыть обильно струей воды, затем 1%-ным раствором уксусной кислоты (находится в уголке по технике безопасности) и опять обильно водой. Углеводы Моносахариды. Строение моносахаридов. Стереохимия моносахаридов. Дисахариды. Восстанавливающие и невосстанавливающие дисахариды. Инверсия сахарозы, условия проведения. Полисахариды. Строение крахмала и клетчатки. Гидролиз крахмала: условия проведения, продукты гидролиза, взаимодействие с иодом. Пентозаны. Получение фурфурола. Нахождение в природе и использование полисахаридов.  Синтез 1,2,3,4,6-b-пентаацетилглюкопиранозида Уравнения основных реакций:
Реактивы Основные
Вспомогательные
Посуда и приборы
Выполнение синтеза Тщательно растирают и смешивают в фарфоровой чашке со ступкой 5 г растертой в порошок безводной глюкозы с 265 г безводного ацетата натрия. Смесь помещают в круглодонную колбу емкостью 100 см3 и добавляют при размешивании 23 см3 уксусного ангидрида. Колбу соединяют с обратным холодильником, закрытым хлоркальциевой трубкой (рис. В.3), и нагревают на кипящей водяной бане в течение 2,5 часа при периодическом перемешивании реакционной смеси (путем покачивания вместе со штативом). По окончании реакции жидкость выливают тонкой струей (при размешивании) в стакан, в который предварительно помещают около 200 см3 воды со льдом. Выпавшую массу белого цвета тщательно размешивают стеклянной палочкой и оставляют на 1,5 часа под слоем воды. В это время происходит гидролиз не вступившего в реакцию уксусного ангидрида. Затем 1,2,3,4,6-b-пентаацетил-глюкопиранозид (белую кристаллическую массу) отфильтровывают на установке для вакуум-фильтрования (рис. В.4), хорошо отжимают на фильтре и перекристаллизовывают из этилового спирта. Для перекристаллизации требуется примерно 50 см3 этилового спирта. Перекристаллизацию ведут следующим образом. Растворяют сырой продукт в небольшом количестве кипящего спирта в колбе с обратным холодильником Выход 1,2,3,4,6-b-пентаацетилглюкопиранозида9 г. G Техника безопасности.Используемый при синтезе уксусный ангидрид огнеопасен. Очень сильно действует на кожу даже при кратковременном контакте. Так же огнеопасен используемый при перекристаллизации этиловый спирт. Образует с воздухом взрывчатую смесь (2,6-18,9% спирта по объему). 1,2,3,4,6-b-пентаацетилглюкопиранозид – бесцветное кристаллическое вещество. Растворимость: в 100 г воды 0,09 г (при 18°С); в 100 г этилового спирта 0,82 г (при 19°С); в 100 г диэтилового эфира 2,1 г (при 15°С. Тпл = 131°С. Синтез фурфурола Основная реакция синтеза: Гидролиз пентозанов, содержащихся в подсолнечной лузге или початках кукурузы до пентоз : H+ (C5H804)n + nH20 ¾¾¾® nC5H10O5
Реактивы Основные
Вспомогательные
Посуда и приборы
Выполнение синтеза В колбу Вюрца, снабженную капельной воронкой и холодильником Либиха (рис. В.5), помещают 50 г мелкоизмельченной подсолнечной лузги или кукурузных початков и приливают из капельной воронки 95 см3 соляной кислоты в 180 см3 воды. Колбу нагревают на электроплитке и медленно отгоняют жидкость; по мере уменьшения объема жидкости в колбе из капельной воронки добавляют 25 г соляной кислоты в 260 см3 воды. Перегонку прекращают, когда объем дистиллята составит 350 см3 . Дистиллят нейтрализуют кальцинированной содой (прибавляют небольшими порциями при перемешивании),насыщают порошкообразным хлоридом натрия и переносят в колбу Вюрца. Присоединяют нисходящий холодильник и отгоняют примерно 1/3 объема смеси. Первые фракции, представляющие собой эмульсию, собирают отдельно. Эмульсии дают отстояться, отделяют фурфурол в делительной воронке, а водный слой присоединяют ко второй части дистиллята. Дистиллят насыщают хлоридом натрия и 1/3 его отгоняют. Отгон снова насыщают хлоридом натрия и экстрагируют эфиром три раза, добавляя эфир небольшими порциями (по 25 см3). Перед вторым экстрагированием в дистиллят снова добавляют хлорид натрия до насыщения. Эфирную вытяжку присоединяют к фурфуролу и сушат безводным сульфатом натрия. Эфир осторожно отгоняют на водяной бане и остаток перегоняют, собирая фракцию с Ткип = 160-162°С. Выход фурфурола 4,8 г. G Техника безопасности.Используемый при перекристаллизации диэтиловый эфир крайне огнеопасен и образует с воздухом взрывчатую смесь (1,2-51% по объему. При отгонке эфира следует проявлять чрезвычайную осторожность по причине его высокой летучести (Ткип = 34,6°С) и неполной конденсации паров эфира в холодильнике. Вдыхание паров эфира в помещении вызывает быстрое к нему привыкание и потерю чувствительности. Поэтому при отгонке необходимо использовать достаточно длинный нисходящий холодильник; на отводную трубку аллонжа рекомендуется надеть резиновую трубку и другой ее конец опустить в сток водопроводной раковины или вывести под тягу. Фурфурол – маслянистая, бесцветная, желтеющая на воздухе жидкость с запахом, напоминающим запах свежеиспеченного хлеба. Список литературы Основная 1. Лабораторные работы по органической химии: Учебное пособие для вузов. / Под ред. О.Ф.Гинзбурга и А.А.Петрова. – М.: Высшая школа, 1982. – 317 с. 2. Травень Ф.В. Органическая химия: Учебник для химико-технологических вузов. В 2-х Т. Т. 1,2. – М.: Академкнига. 2004.–1310 с. 3. Нечаев А.П. Органическая химия: Учебник для вузов / А.П.Нечаев, Т.В.Еременко. – М.:Высшая школа, 1985.–463 с. 4. Петров А.А. Органическая химия: Учебник для вузов /А.А.Петров, Х.В.Бальян, А.Р.Трощенко. – М.:Высшая школа, 1981.– 592 с. Дополнительная 1. Органикум. Практикум по органической химии. В 2-х Т. Т.1-2. / Пер. с нем. под ред. В.М.Потапова. – М.: Мир, 1979. – 890 с. 2. Несмеянов А.Н. Начала органической химии. В 2-х кн. Кн. 1, 2. / А.Н Несмеянов., Н.А.Несмеянов. 2-е изд., перераб. – М.: Химия, 1974. – 1067 с. 3. Бойд Р. Органическая химия. Пер. с англ. / Р.Бойд, Р.Моррисон. – М.: Мир, 1974. – 1132 с. 4. Препаративная органическая химия. Перевод с польского, под ред. Н.С.Вульфсона – Л.: Химия, 1964. – 720 с. 5. Лернер И.М. Указатель препаративных синтезов органических соединений / И.М.Лернер, А.И Берлин, Н.М.Словачевская – М.: Химия, 1983. – 277 с. 6. Потапов В.М. Химическая информация. Как искать химику нужные сведения. Справочник. / В.М. Потапов, Э.К. Кочетова.– М.: Химия. 1988. – 262 с. 7. Маки Р. Путеводитель по органическому синтезу / Р.Маки, Д.Смит – М.:Мир. 1985. – 352 с. 8. Пейн Ч. Как выбирать путь синтеза органического соединения / Ч.Пейн, Л.Пейн. – М.: Мир. 1973. – 159 с. 9. Рабинович В.А. Краткий химический справочник: справочное издание / В.А.Рабинович, З.Я.Хавин ; под ред. А.А.Потехина и А.И.Ефимова. 4-е изд., стереотипное. – СПб: Химия, 1994. – 432 с. 10. Свойства органических соединений: Справочник / Под ред. А.А.Потехина. – Л.: Химия, 1984. – 517 с. Методические указания 1. Роганов Г.Н., Баранов О.М., Емельяненко В.Н. «Методы очистки». Методические указания к лабораторным работам по курсу органической химии. Для студентов всех технологических специальностей дневной и заочной форм обучения. – Могилев: Ротапринт МГТИ, 2002 г. – 20 с. 2. Баранов О.М. Методы хроматографического анализа органических соединений. Методические указания по курсу «Органическая химия» 3. Гузиков А.Я., Баранов О.М. Анализ органических соединений (УИРС). Методические указания к лабораторным занятиям по курсу «Органическая 4. Баранов О.М. Аналитическое применение ИК-спектроскопии в органической химии. Методические указания к учебной исследовательской работе. – Могилев: Ротапринт МТИ, 1997 г. – 36 с. 5. Геллер Б.Э., Сорокина Г.С. Методические указания по выполнению учебной исследовательской работы в химических лабораториях института. Техника лабораторных работ. – Могилев: Ротапринт ПКТИАМ, 1987 г. – 33 с.
Приложение А (справочное)
Министерство образования Республики Беларусь Учреждение образования МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ
Кафедра химической технологии высокомолекулярных соединений
СИНТЕЗ БРОМИСТОГО ЭТИЛА Лабораторная работа № 1 по дисциплине «Органическая химия» Специальность 48 01 02 Химическая технология органических веществ, Специализация 48 01 02 02 Технология химических волокон
Могилев, 200_ Приложение Б (справочное) Основные физические константы соединений, Таблица Б.1 – Органические соединения
* ац – ацетон; бзл – бензол; мет – метанол; сп – спирты; тол – толуол; укс – уксусная кислота; хлф – хлороформ; эт – этанол; эф – эфир; пир – пиридин. р. – растворим; х. р. – хорошо растворим; м. р. – мало растворим; н. р. – не растворим; ¥ – бесконечно растворим.
Таблица Б.2 – Неорганические соединения
* ац – ацетон; бзл – бензол; мет – метанол; сп – спирты; укс – уксусная кислота; хлф – хлороформ; эт – этанол; эф – эфир; пир – пиридин; глиц – глицерин. ¥ – бесконечно растворим; р. – растворим; х. р. – хорошо растворимо: м. р. – мало растворимо; н. р. – не растворим; реаг – реагирует. ** Na2Cr2O7×2H2O Приложение В (справочное) Рисунки основных приборов и установок,
1 – круглодонная реакционная колба; 2 – дефлегматор;3 – термометр; Рисунок В.1 – Установка для синтеза
1 – перегонная колба; 2 – насадка Вюрца; 3 – термометр; 4 – холодильник нисходящий; 5 – аллонж; 6 – колба-приемник; 7 – электронагреватель; Рисунок В.2 – Установка для перегонки при атмосферном давлении
1 – колба для кипячения раствора; 2 – обратный холодильник; Рисунок В.3 – Установка для синтеза
1 – колба Бунзена, 2 – воронка Бюхнера, 3 – вакуумный шланг; 4 – предохранительная склянка (склянка Вульфа), 5 – воздушный кран
Рисунок В.4 – Установка для вакуумного фильтрования
1 – реакционная колба; 2 – насадка Вюрца; 3 – капельная воронка; 4 – термометры; 5 – холодильник Либиха; 6 – аллонж; 7 – приемная колба; Рисунок В.5 – Установка для синтеза
1 – реакционная колба; 2 – водоотделитель; 3 – обратный холодильник; 4 – электронагреватель; 5 – штатив лабораторный Рисунок В.6 – Установка для синтеза
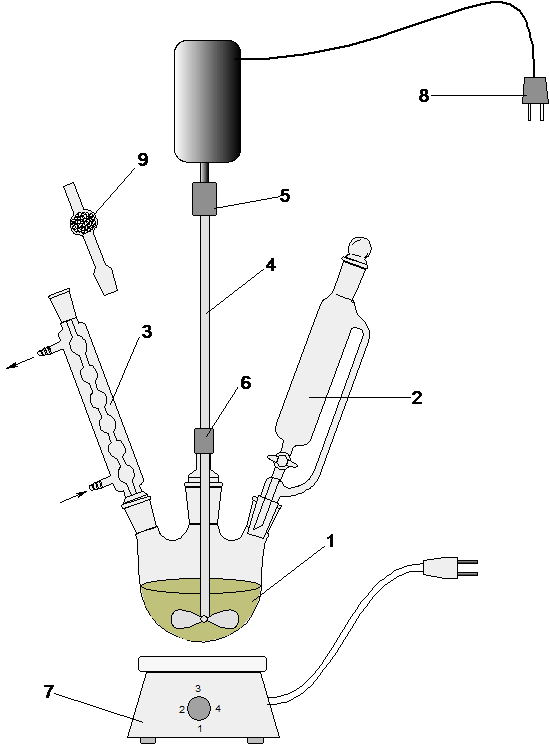
1 – реакционная колба; 2 – капельная воронка; 3 – холодильник обратный; 4 – мешалка лопастная; 5 – соединительная муфта; 6 – уплотнительная муфта; 7 – электронагреватель; 8 – вилка подсоединения к ЛАТРу; 9 – хлоркальциевая трубка Рисунок В.7–Установка для проведения реакций,
1 – перегонная колба; 2 – капилляр; 3 – уплотнительная резиновая трубка; Рисунок В.8 – Установка для перегонки в вакууме СИНТЕЗЫ
Подписано в печать _______________ Формат 60´84 1/16 Печать офсетная. Усл. печ. л. 3,5 Уч.-изд. л. ______ Тираж 250 экз. Заказ ___________ Бесплатно ЛП № 226 от 12.02.2003 г. ЛИ № 604 от 03.06.2003 г. Отпечатано на ризографе УО МГУП 212027, г. Могилев, пр. Шмидта, 3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 1037. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




 Пример оформления титульного листа отчета
Пример оформления титульного листа отчета