Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Основные типы диаграмм состояния сплавовДля характеристики изменений структуры сплавов в зависимости от состава и температуры строят диаграммы состояния. Они представляют собой графическое изображение равновесного или неравновесного состояния сплавов и строят их в координатах температура — состав. Равновесное состояние сплавов достигается при малых скоростях охлаждения или длительном нагреве. Неравновесное состояние, приводящее к повышению механических и других свойств, характеризуется ограниченной устойчивостью и способностью перехода в другие устойчивые состояния. Диаграммы состояния обычно строятся с помощью термического метода анализа металлов и сплавов. Сущность метода сводится к определению критических точек металлов и сплавов. Строят кривые охлаждения, которые выражают графическую зависимость между изменением температуры металла (сплава) при охлаждении и временем, в течение которого эти изменения происходят. Эти кривые строятся в координатах температура (ось ординат) — время охлаждения (ось абсцисс). Так как фазовые превращения в металлах и сплавах сопровождаются тепловыми эффектами, то на кривых охлаждения можно наблюдать либо остановки (площадки), либо перегибы. Появление площадки говорит о том, что фазовые превращения происходят при постоянной температуре. Перегибы появляютсяв результате изменения скорости охлаждения, в этом случае фазовые превращения протекают в интервале температур. Температура начала и конца фазовых превращений, определеяемые по кривым охлаждения, называются критическими. Соответсвующие им точки на кривых охлаждения называются критическими точками.  Диаграмма состояния двойных сплавов — первого типа, образующих при затвердевании механическую смесь, характеризует сплавы, компоненты которых в жидком состоянии неограниченно растворимы друг в друге, а в твердом состоянии нерастворимы и не образуют химического соединения. По диаграмме состояния первого типа кристаллизуются сплавы Рb—Sb; Рb—Sn; Zn—Sn и др.
Диаграмма состояния (рис.9) сплавов свинец — сурьма. Выше линии АВС все сплавы представляют собой однофазный жидкий раствор (ж. р.). Эта линия называется линией ликвидус (с греч.-жидкий), линия DВE— линия солидус (с греч.- твердый). Ниже линии DВE все сплавы находятся в твердом состоянии. Сплав, соответствующий точке В, называется эвтектичеcким. Для данной системы он имеет строго определенный состав (87% Рb и 13% Sb) и обладает самой низкой температурой плавления (246 °С). Сплавы, расположенные влево от эвтектики, называются доэвтектическими, а вправо — заэвтектическими. В доэвтектических сплавах сначала при охлаждении ниже, линии ликвидус АВ выделяются кристаллы свинца, а в заэвтектических ВС— кристаллы сурьмы. После затвердевания, т.е. ниже линии солидус, доэвтектические сплавы состоят из кристаллов свинца и эвтектики, а заэвтектические — из кристаллов сурьмы и эвтектики. Пользуясь диаграммой состояния, можно определить температуру начала и конца кристаллизации сплавов и их строение. Диаграмма состояния двойных сплавов — второго типа (рис. 10) характеризует сплавы, компоненты которых обладают полной взаимной растворимостью, как в жидком, так и в твердом состояниях и не образуют химических соединений. По диаграмме состояния второго типа кристаллизуются сплавы Сu —Ni, Fе —Ni, Fе — Сг, Вi — Sb и др. Линия АтВ — линия ликвидус, линия АпВ — линия солидус, ниже этой линии сплавы находятся в виде твердых растворов (т.р.). Между линией ликвидус и солидус находится двухфазная область, в которой одновременно существуют кристаллы твердого раствора и жидкий раствор.
Диаграмма состояния сплавов с ограниченной растворимостью в твердом состоянии — третьего типа — характеризует сплавы, у которых оба компонента неограниченно растворимы в жидком состоянии, ограниченно — в твердом, образуют при кристаллизации эвтектику (рис.11). Сюда относятся системы А1 — Сu, Fе — С, Мg —А1, Мg —Zn и др. Линия АEВ — линия ликвидус, выше этой линии сплавы находятся в жидком состоянии; линия АDЕСВ — линия солидус, ниже этой линии сплавы находятся в твердом состоянии. По линии АЕ выделяются кристаллы твердого раствора компонента F в К, которому присвоено название α-твердого раствора, по линии ВЕ выделяются кристаллы твердого раствора К в F, который обозначим β. Предельная растворимость F в К определяется линией DD', а предельная растворимость К в F определяется линией CC' . Как видно из диаграммы, растворимости F в К и К в F меняется с изменением температуры. Может быть такой случай, когда компонент F растворим в К и растворимость изменяется с изменением температуры (линия DD'), а растворимость K в F не изменяется с изменением температуры (линия СG). Область АDЕА представляет собой жидкий раствор и кристаллы твердого α-раствора; область ВЕСВ — жидкий раствор и кристаллы твердого β-раствора; область АDD'КА — кристаллы твердого α-раствора; область ВСС'FВ — кристаллы твердого β-раствора. Область DЕЕ'J — эвтектику, кристаллы α-раствора и βII-фазы; область ЕGGЕ' — эвтектику, кристаллы β-раствора и αII-фазы)
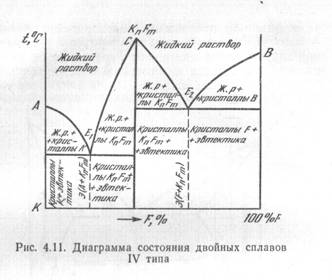
Диаграмма состояния с устойчивым химическим соединением — четвертого типа - характеризует сплавы, компоненты которых неограниченно растворимы и в жидком состоянии, нерастворимы в твердом и образуют устойчивое химическое соединение (рис.12). К таким системам относятся сплавы Мg - Cu и др.
Линия АЕ1СЕ2В — линия ликвидус. Эта диаграмма как бы составлена из двух диаграмм первого типа. Химическому соединению КпFт соответсвует точка С. На диаграмме эвтектический сплав, соответствующий точке Е1 , представляет собой механическую смесь кристаллов К и химического соединения КпFт, а эвтектический сплав Е2 - смесь кристаллов F и химического соединения КпFт. Фазовый состав диаграммы может быть определен по аналогии с диаграммой первого типа.
Правило фаз и отрезков Фазами могут быть жидкие растворы, твердые растворы и химические соединения. Следовательно, однородная жидкость представляет собой однофазную систему, механическая смесь двух видов кристаллов — двухфазную систему и т. д. Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которые можно изменять без изменения числа фаз в системе. Количественную зависимость между числом степеней свободы системы, находящейся в равновесном состоянии, и числом компонентов и фаз принято называть правилом фаз (закон Гиббса). Правило фаз для металлических систем выражается уравнением С = К - Ф + m, где С —число степеней свободы системы; К —число компонентов; Ф — число фаз; т — число внешних факторов (температура, давление). Если принять, что все превращения происходят при постоянном давлении (Р = const), это уравнение примет следующий вид: С = К – Ф + 1, где 1 - внешний переменный фактор (температура). Пользуясь правилом фаз, рассмотрим, как происходит изменение числа степеней свободы однокомпонентной системы для случая расплавленного чистого металла (К=1; Ф=1) С = 1-1 + 1 = 1, т.е. температуру можно изменять не меняя числа фаз. Такое состояние системы называют моновариантным (одновариантным). В процессе кристаллизации Ф = 2 (две фазы — жидкая и твердая), а К=1, тогда С= 1-2+1=0. Это значит, что две фазы находятся в равновесии при строго определенной температуре (температура плавления), и она не может быть изменена, пока одна из фаз не пропадет. Такое состояние системы называют нонвариантным} (безвариантным).Для диухкомпонентной системы, находящейся в жидком состоянии (К = 2; Ф=1), правило фаз имеет вид С = 2-1 + 1=2, такая система называется бивариантной (двухвариантной). В этом случае возможно изменение двух факторов равновесия (температуры и концентрации), число фаз при этом не меняется. Для этой же системы при существовании двух фаз (жидкой и твердой) К=2, Ф = 2, согласно правилу фаз С = 2—2+1 = 1, т.е. с изменением температуры концентрация должна быть строго определенной. Применение правила фаз для диаграммы состояния первого типа(см. рис. ). Пользуясь этой диаграммой, можно определить фазовое состояние сплавов любого состава при любой температуре. Так, например, в области 1 существует одна фаза — жидкий раствор. Правило фаз запишется в виде С = К – Ф + 1 = 2- 1 + 1 = 2, т. е. система имеет две степени свободы. Для остальных областей 2, 3, 4 и 5 система характеризуется одной степенью свободы (С = 2 – 2 + 1 = 1). Для определения количества составляющих пользуются правилом отрезков. Например, из точки к (см. рис.) проводят перпендикуляр I-I, соответствующий сплаву, содержащему 80 % Sb и 20 % Pb. Затем при заданной температуре t1 через точку d проводят горизонтальную прямую до пересечения с линиями, ограничивающими данную область диаграммы, получая таким образом точки е и b. Если обозначить массу жидкости буквой Ж, а массу всего сплава буквой В, то мождо записать Ж/В = db/eb. Если массу всего сплава принять за 100%, то количество жидкой фазы определится соотношением Ж = db/eb · 100 %. По аналогии, для твердой фазы: Т=ed/eb·100%. Перпендикуляр I-I делит линию еb в 60 единиц (от 40 до 100 % по оси концентраций) на отрезки еb=40 ед и db=20ед. Таким образом из приведенных выражений находим, что искомый сплав при температуре t1 будет содержать 33 % жидкого сплава и 67 % твердой фазы. Правило отрезков позволяет определить также и концентрацию компонентов в фазах. Так, выше точки 1 сплав находится в однофазном состоянии, и концентрация компонентов в жидком сплаве определяется проекцией этой точки на ось концентраций. При температуре концентрация компонента 5Ь в жидкости определяется проекцией точки е. Выделяющиеся же кристаллы представляют чистую сурьму, так как точка Ь лежит на вертикальной оси 5Ь, 100%.
|
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 441. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 Из приведенных кривых на рис.8,а чистые металлы (Рb, Sb) и эвтек-тические__сплавы (рис. 8, в) имеют одну критическую точку, а сплавы — две (рис.8 б, г).Верхняя критическая точка соответствует началу, а нижняя — концу затвердевания, причем нижняя критическая точка для всех сплавов одинакова и равна 246 °С.
Из приведенных кривых на рис.8,а чистые металлы (Рb, Sb) и эвтек-тические__сплавы (рис. 8, в) имеют одну критическую точку, а сплавы — две (рис.8 б, г).Верхняя критическая точка соответствует началу, а нижняя — концу затвердевания, причем нижняя критическая точка для всех сплавов одинакова и равна 246 °С.