Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение ферментации лактозыОставшуюся часть оксидазоотрицательной грамотрицательной колонии засевают в две пробирки с полужидкой лактозной средой и жидкой лактозо-пептонной средой (ЛПС). В состав жидкой лактозо-пептонной среды(ЛПС) входят 10 г пептона, 5 г натрия хлорида и 5 г лактозы, которые растворяют при нагревании Для приготовления среды накопления(концентрированной ЛПС), используя титрационный метод, увеличивают количество всех ингредиентов (кроме воды) в 10 раз и разливают по 10 см3 во флаконы с поплавками. Перед стерилизацией в ЛПС, используемую для подтверждения способности бактерий к ферментации лактозы до кислоты и газа, добавляют 1,6% спиртовой раствор бриллиантового синего из расчёта 1 см3 красителя на 1 л ЛПС (при образовании кислоты зелёный цвет ЛПС изменяется на жёлтый). Для работы мембранным методом готовую ЛПС разливают по 3-5 см3 в пробирки с поплавками. Для обнаружения ОКБ посевы в ЛПС с индикатором инкубируют при температуре 37 °С в течение 48 ч. Для обнаружения ТКБ посевы инкубируют при температуре 44 °С в течение 24 ч. При обнаружении кислоты и газа результат исследования считают положительным. При отсутствии кислоты и газа или при наличии только кислоты через 24 ч пробирки оставляют в термостате до 48 ч. При положительных результатах КОЕ ОКБ и ТКБ подсчитывают на всех фильтрах и выражают результат анализа КОЕ в 100 см3 воды. Вычисления проводят по формуле: Х= а×100/v, где Х – число колоний в 100 см3; а – число подсчитанных на фильтрах колоний в сумме;  v – объем воды, профильтрованный через фильтры. Окончательный результат выдают в следующем формате: количество КОЕ ОКБ в 100 см3, из них – количество КОЕ ТКБ в 100 см3.
3. Определение спор сульфитредуцирующих клостридий методом прямого посева
Метод основан на выращивании посевов в железо-сульфитном агаре в условиях, приближённых к анаэробным, и подсчёте числа чёрных колоний. На первом этапе исследования пробу воды объёмом 20 см3 прогревают на водяной бане в пробирках при температуре 75 °С в течение 15 мин для уничтожения вегетативных форм микроорганизмов. Затем в 4 стерильные пробирки объёмом не менее 15 см3 вносят по 5 см3 подготовленной пробы воды и заливают горячим, расплавленным на водяной бане (не кипятить!) железо-сульфитным агаром по 10 см3 в каждую пробирку. Среду заливают по стенке пробирки, избегая образования пузырьков воздуха. После этого пробирку быстро охлаждают в ёмкости с холодной водой для создания анаэробных условий. Посевы инкубируют при температуре 44 °С в течение 16-18 ч. Количественному учёту подлежат те посевы, где получены изолированные чёрные колонии в толще питательной среды. Результат выражают числом КОЕ спор сульфитредуцирующих клостридий в 20 см3 воды. В случае сильного роста результат оценивают качественно и в протоколе отмечают: «Обнаружено в 20 см3 воды». При отсутствии роста чёрных колоний дают ответ: «Не обнаружено в 20 см3 воды».
Заключение _________________________________________________
4. Определение коли-фагов
Метод определения коли-фагов в питьевой воде заключается в предварительном накоплении их в среде обогащения на культуре Е. coli и последующем выявлением зон лизиса (просветления) газона Е. coli на питательном агаре. Метод предназначен дли проведения текущего контроля качества питьевой воды. На всех этапах исследования используют бактериальную взвесь, при-готовленную следующим образом: эталонную тест-культуру Е. coli К-12 F+ Smr засевают в пробирку со скошенным питательным агаром. Через 18 ч инкубации при температуре 37 °С проводят смыв бактерий с косого агара 5см3 0,9% раствором натрия хлорида и по стандарту мутности готовят взвесь Е. coli в концентрации 109 бактериальных клеток в 1см3. Можно использовать 4-часовую бульонную культуру Е. coli, 2 см3 такой культуры содержат 109 бактериальных клеток. В начале исследования 100 см3 исследуемой пробы воды разливают на 6 объёмов: один флакон 50 см3 и 5 пробирок по 10 см3. В 50 см3 пробы воды добавляют 5 см3 питательного бульона 10-кратной концентрации (готовят путём увеличения в 10 раз навески сухого препарата, указанной на этикетке) и 0,5 см3 смыва (или 1 см3 4-часовой бульонной культуры) бактерий Е. coli. Дли контроля культуры 0,1 см3 смыва бактерий (или 0,2 см3 4-часовой бульонной культуры) Е. coli помешают в чашку Петри и заливают ни питательным агаром. Посевы переносят в термостат и выдерживают при температуре 37 °С в течение 18 ч. После инкубации из объёма 50 см3 отмеряют 10 см3 в пробирку. Во все пробирки (6 объёмов пробы воды по 10 см3) добавляют по 1 см3 хлороформа. Пробирки закрывают стерильными резиновыми пробками, встряхивают для равномерного распределения хлороформа по объёму воды и оставляют на 15 мин при комнатной температуре (Е. coli погибают, остаются только коли-фаги). В 100 см3 расплавленного и остуженного до температуры 45 °С питательного агара добавляют 1 см3 смыва суточной агаровой культуры Е. coli (в концентрации 109/см2 смыва) или 2 см3 4-часовой бульонной культуры Е. coli. Приготовленную смесь разливают в чашки Петри: одну чашку для контроля культуры Е. coli на лизогенность и по одной чашке на каждую исследуемую пробу воды. После застывания агара чашки, предназначенные для посева пробы, делят на 6 секторов, маркируют каждый сектор в соответствии с исследуемыми объёмами и на каждый сектор наносят пастеровской пипеткой по 1 капле надосадочной жидкости (без хлороформа) из 6 пробирок с пробой. После подсыхания капель чашки с исследуемыми пробами и контрольную чашку помещают в термостат при температуре 37 °С на 18 ч. Просмотр результатов осуществляют в проходящем свете. Учитывают зоны лизиса в виде отдельного пятна или отдельной бляшки. Пробу считают положительной при наличии зоны лизиса хотя бы на одном секторе при отсутствии зон лизиса на контрольной чашке. Оценку проводят по таблице НВЧ БОЕ. В протоколе анализа указывают НВЧ коли-фагов в 100 см3 воды и диапазон возможных колебаний: НВЧ БОЕ коли-фагов в 100 см3. Результат полуколичественный. При наличии зон лизиса в контрольной чашке результат считают недействительным.
Контрольные вопросы По каким показателям определяется безопасность питьевой воды в эпидемическом отношении? Какие санитарно-показательные микроорганизмы используют для оценки качества питьевой воды? Какие микробиологические показатели определяют при оценке качества питьевой воды централизованного водоснабжения? Как определяют ОМЧ воды? Что такое ОКБ? Что такое ТКБ? Каким способом подтверждают наличие ОКБ в пробе воды? Как определяют ТКБ воды? В чем сущность метода мембранных фильтров при определении ОКБ и ТКБ воды? Какие фильтры используют при исследовании воды? Как осуществляется постановка оксидазного теста? Как определяется ферментация лактозы? Какой состав жидкой ЛПС? Как проводят определение спор сульфитредуцирующих клостридий при оценке качества питьевой воды централизованного водоснабжения? В чем заключается метод определения коли-фагов? Какой состав железо-сульфитного агара? Какие основные правила отбора проб воды? В течение какого промежутка времени проба питьевой воды должна быть доставлена на анализ? Для каких возбудителей инфекционных заболеваний вода может служить фактором передачи? Назовите с эпидемиологической точки зрения наиболее опасные для человека вирусы, загрязняющие водоемы? Назовите единицы измерения, в которых выражают количество коли-фагов в воде? Какие методы обнаружения микроорганизмов в воде вы знаете? Что такое гомогенизация и десорбция?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №2 1. Правила отбора проб воды: 1. Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения, изготовленные из материалов, не влияющих на жизнедеятельность микроорганизмов. Емкости должны быть оснащены плотно закрывающимися пробками (силиконовыми, резиновыми или из других материалов) и защитным колпачком (из алюминиевой фольги, плотной бумаги). Многоразовая посуда, в т.ч. пробки, должна выдерживать стерилизацию сухим жаром или автоклавированием. 2. Для нейтрализации присутствующих в воде хлорсодержащих дезинфектантов в ёмкость (до стерилизации) вносят серноватисто-кислый натрий из расчёта 10 мг на каждые 0,5 объёма исследуемой воды. Если вода гиперхлорированная, то количество нейтрализатора увеличивают: при концентрации остаточного хлора 2 мг/л добавляют 20 мг нейтрализатора, 3 мг/л - 30 мг и так далее. 3. Стерильную емкость открывают непосредственно перед отбором, удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего-либо касаться. 4. При исследовании воды из распределительных сетей отбор проб из крана производят после предварительной его стерилизации обжиганием и последующего спуска воды не менее 10 мин при полностью открытом кране. При отборе пробы напор воды может быть уменьшен. Пробу отбирают непосредственно из крана без резиновых шлангов, водораспределительных сеток и других насадок. 5. При заполнении емкостей должно оставаться пространство между пробкой и поверхностью воды, чтобы пробка не смачивалась при транспортировании. После наполнения емкость закрывают стерильной пробкой и колпачком. 6. Отобранную пробу маркируют и сопровождают документом отбора проб воды с указанием места, даты, времени забора, фамилии специалиста, отбиравшего пробу, и другой информации. 2. Хранение и транспортирование проб воды 1. Доставку проб питьевой воды осуществляют в контейнерах-холодильниках при температуре (4-10) °С. 2. В холодный период года контейнеры должны быть снабжены термоизолирующими прокладками, обеспечивающими предохранение проб от промерзания. При соблюдении указанных условий срок начала исследований от момента отбора проб не должен превышать 6 ч. 3. Если пробы нельзя охладить, их анализ следует провести в течение 2 ч после забора. 4. Если не может быть соблюдено время доставки пробы и температура хранения, анализ пробы проводить не следует.
3. Методы обнаружения микроорганизмов в воде. Для обнаружения микроорганизмом в воде и других биосубстратах и определения их количества могут быть использованы бактериологическийи микроскопическийметоды. Основные этапы бактериологического исследования: гомогенизация образца, десорбция микроорганизмов с плотных частиц, приготовление разведений, посев на питательные среды, идентификация выделенных культур. Гомогенизациюобразца проводят для равномерного распределения бактерий в анализируемом объекте. При исследовании жидких, плотных, сыпучих продуктов, в зависимости от характеристик испытуемого материала, используют перемешивание простым встряхиванием или специальные приборы. Десорбциябактерий с плотных частиц необходима для анализа объектов твёрдой консистенции. Для этого материал суспензируют в жидкости или с поверхности объекта берут смывы и отпечатки. При суспензировании к навеске образца массой 10 г добавляют 90 см3 воды и интенсивно перемешивают (вручную или в гомогенизаторе). В дальнейшем условно принимают 1 см3 полученной суспензии эквивалентным 0,1 г исходного материала.
4. Термины и определения Общие колиформные бактерии – грамотрицательные, оксидазонегативные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре +37 °С в течение 24-48 ч. Термотолерантные колиформные бактерии – входят в состав ОКБ и обладают всеми их признаками, но ферментируют лактозу до кислоты, альдегида и газа при температуре +44 °С в течение 24 ч. Сульфитредуцирующие клостридии- спорообразующие анаэробные палочковидные микроорганизмы, восстанавливающие сульфит натрия в условиях культивирования на железо-сульфитном агаре при температуре 44 °С в течение 16-18 ч. Коли-фаги– бактериальные вирусы, способные лизировать Е. coli и формировать при температуре 37 °С через 18 ч зоны лизиса бактериального газона (бляшки) на питательном агаре.
5. Пропись железо-сульфитного агара К 1 л стерильного расплавленного питательного агара добавляют 10 г глюкозы, нагревают до растворения, разливают количественно во флаконы, автоклавируют при температуре 112 °С в течение 12 мин (основная среда). 20% раствор натрия сульфита (Na2S03) и 8% раствор железа (II) сульфата (FeS04) или железа (II) хлорида (FeCl2) готовят непосредственно перед использованием в стерильной посуде на стерильной дистиллированной воде. Раствор натрия сульфита нагревают до полного растворения реагента. Перед выполнением анализа в 100 см3 расплавленной основной среды вносят 5 см3 20% раствора натрия сульфита, перемешивают, затем вносят 1 см3 8% раствора железа сульфата, перемешивают и в стерильных условиях разливают в пробирки высоким столбиком по 10-12 см3.
Таблица1. Санитарно-показательные микроорганизмы в воде централизованного хозяйственно-питьевого водоснабжения
З А Н Я Т И Е 3 Дата ______________ Тема: Санитарно-микробиологическое исследование воды децентрализованного хозяйственно-питьевого водоснабжения.
План занятия 1. Разбор микробиологических показателей, применяемых к питьевой воде источников децентрализованного водоснабжения. 2. Определение бактерий группы кишечных палочек по ГОСТу 18963-73. 2.1. Метод мембранных фильтров. 2.2. Титрационный метод. 3. Определение бактерий группы кишечных палочек по ГОСТу 24849-81.
Методические указания 1. Разбор микробиологических показателей, применяемых к питьевой воде источников децентрализованного водоснабжения В соответствии с СанПиН 2.1.4.1175-02 устанавливаются гигиенические требования к качеству воды, выбору места расположения, оборудованию и содержанию водозаборных сооружений и прилегающей к ним территории. В питьевой воде источников децентрализованного водоснабжения без разводящей сети труб из микробиологических показателей нормируются: - ОМЧ – не более 100 КОЕ/см3 - ОКБ – отсутствие в 100 см3 - ТКБ - отсутствие в 100 см3 - коли-фаги - отсутствие в 10 см3 - исследование на ТКБ и коли-фаги проводят при неблагополучной эпидемиологической обстановке территории. ОМЧ, ОКБ, ТКБ, коли-фаги для воды децентрализованного водопользования определяются по тем же методикам, что и для воды централизованного водопользования. БГКП определяют согласно ГОСТ 18963-73. 2. Определение бактерий группы кишечных палочек по ГОСТу 18963-73 2.1. Метод мембранных фильтров
Этап подготовки и проведения анализа проходит, как при исследовании на ОКБ по МУК 2.1.4.1074-01 (см. выше Занятие №2). На втором этапе идентификации лактозонегативные колонии по ГОСТу 18963-73 (в отличие от МУК 2.1.4.1074-01) отправляют на дальнейшее исследование на способность ферментировать глюкозосодержащую среду до кислоты и газа при температуре 37 °С.
2.2. Титрационный метод Производят посев объёмов пробы воды в ГПС: 100 и 10 см3 пробы – флакон и пробирку со 100 и 10 см3 концентрированной ГПС соответственно, 1 и 0,1 см3 пробы – в пробирки с 10 см3 ГПС нормальной концентрации. Инкубируют при температуре 37 °С в течение 24 ч. При изменения цвета, образовании газа и помутнении ГПС делают высев на секторы среды Эндо. Дальнейшее исследование проводят, как описано в методе мембранных фильтров. Результаты учитывают по табл. 1.
3. Определение бактерий группы кишечных палочек по ГОСТу 24849-81 Для экстремальных ситуаций и в полевых условиях определённый интерес представляет исследование питьевой воды на БГКП по ГОСТу 24849-81 «Вода питьевая. Полевые методы санитарно-микробиологического анализа». В нём представлена методика исследования воды титрационно-сигнальным методом, как одним из самых доступных вариантов. Пробы воды объёмом 100, 10, 1,0, 0,1 и 0,01 см3 сеют на среду КОДА, которую готовят из готовой сухой смеси. Пробы воды объёмом 100 и 10 см3 вливают во флаконы или пробирки со 100 и 10 см3 концентрированной среды КОДА соответственно (для её приготовления берут удвоенную навеску сухой среды); 1 см3 воды и 0,1 см3 из разбавлений - в пробирке с 10 см3 среды нормальной концентрации. Посевы инкубируют при температуре 37 °С в течение 48 ч. Предварительный учёт проводят через 24 ч, окончательный – через 48 ч. Положительным результатом теста считают появление мути и изменение цвета индикатора. Коли-индекс (индекс БГКП) вычисляют по табл. 1.
Контрольные вопросы Что называется нецентрализованным водоснабжением? Что служит источниками нецентрализованного водоснабжения? По каким показателям определяется безопасность питьевой воды децентрализованного водоснабжения в эпидемическом отношении? Какие нормативные документы регламентируют исследование воды нецентрализованного водоснабжения? Какие приборы используются для отбора проб воды с глубины? Как определяют ОМЧ воды? Что такое ОКБ? Какие питательные среды используют при определении колиформных бактерий в питьевой воде? Какая среда используется для первичного посева при определении колиформных бактерий в питьевой воде методом мембранных фильтров? Что такое ТКБ? Какой метод оценки качества питьевой воды применяется в полевых условиях? ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №3
Нецентрализованным водоснабжением является использование для питьевых и хозяйственных нужд населения воды подземных источников, забираемой с помощью различных сооружений и устройств, открытых для общего пользования или находящихся в индивидуальном пользовании, без подачи ее к месту расходования. Источниками нецентрализованного водоснабжения являются подземные воды, захват которых осуществляется путем устройства и специального оборудования водозаборных сооружений (шахтные и трубчатые колодцы, каптажи родников) общего и индивидуального пользования.
Таблица 1. Расчет индекса бактерий группы кишечной палочки
З А Н Я Т И Е 4 Дата ______________
Тема: Санитарно-микробиологическое исследование почвы
План занятия: 1. Отбор и предварительная обработка образцов почвы. 2. Определение общего количества бактерий в почве. 3. Определение бактерий группы кишечных палочек. 3.1. Бродильный (титрационный) метод. 3.2. Метод мембранных фильтров 3.3. Прямой поверхностный посев на плотные питательные среды 4. Определение перфрингенс-титра. 4.1. Посев почвенных разведений в среду Вильсона-Блера. 4.2. Использование сред накопления для определения клостридий в почве. 5. Определение термофильных бактерий. 6. Определение нитрифицирующих бактерий
Методические указания
1. Отбор и предварительная обработка образцов почвы
При определении степени загрязнения почвы промышленными источниками места для отбора проб располагают на площади трёхкратной величины санитарно-защитной зоны вдоль вектора розы ветров на расстоянии 100, 200, 300, 1000, 5000 м и более от источника загрязнения (ГОСТ 17.4.4.02-84). При контроле состояния почв в районе точечных источников загрязнения пробные площадки размером 5x5 м закладывают на разном расстоянии от источника и в относительно чистом месте (контроль). На каждой из выбранных площадок пробы отбирают «по правилу конверта» (четыре пробы по углам участка и одну в центре). В месте отбора пробы выкапывают шурф размером 0,3x0,3 м и глубиной 20 см. Для этой цели используют почвенный бур Некрасова. Поверхность одной из стенок шурфа зачищают стерильным ножом и вырезают из этой стенки почвенный образец массой 200 г, что обычно составляет пласт размером 20x3x3 см. При определении степени загрязнения почв химическими веществами, пробы отбирают поверхностно (0-1 см) стерильным инструментом (ножом, шпателем) в количестве 0,3-0,5 кг. При оценке почв сельхоз территорий пробы отбираются два раза в год (весной и осенью) с глубины 0-25 см. На каждые 0-15 га закладывают не менее одной площадки размером 100-200 м2 в зависимости от рельефа местности и условий землепользования. Применяемые для работы инструменты перед взятием каждого нового образца стерилизуют. Все отобранные образцы собирают в отдельные промаркированные пакеты, изготовленные из специальной бумаги «Крафт» или стерильные емкости, которые после заполнения закрывают пробками с бумагой и немедленно доставляют в лабораторию для анализа. Допускается хранение образцов до начала исследования при температуре 4-5 °С не более 24 ч. В лаборатории из 5 точечных проб почвы, взятых с одного участка, готовят усреднённую пробу массой около 500 г, тщательно перемешивая и растирая образцы в стерильной фарфоровой чашке резиновым пестиком в течение 5 мин. Посторонние примеси (корни растений, камни, щепки) удаляют путём просеивания почвы через сито, которое предварительно протирают ватным тампоном, смоченным 96% этиловым спиртом. Из усреднённой пробы отбирают навески (от 1 до 50-55 г в зависимости от определяемых показателей) и готовят суспензию 1:10 на стерильной водопроводной воде (10 г почвы на 90 см3 воды). Для десорбции микроорганизмов с поверхности почвенных частиц приготовленную почвенную суспензию встряхивают в течение 3 мин на мешалке механического диспергатора. После отстаивания суспензии в течение 30с готовят последовательные 10-кратные разведения почвы до концентрации 10-4-10-5 г/см3.
2. Определение общего количества бактерий в почве
Посев проводят в 1,5% МПА – не менее двух различных разведений пробы в зависимости от степени предполагаемого загрязнения исследуемой почвы. Перед посевом каждое разведение тщательно перемешивают стерильной пипеткой, забирают 1 см3 суспензии и переносят на дно стерильной чашки Петри. Из каждого разведения посев проводят минимум в две параллельные чашки. После этого в чашки вливают 15-20 см3 предварительно расплавленного и остуженного до температуры 45 °С питательного агара, тщательно перемешивают с почвенной суспензией и оставляют до застывания в строго горизонтальном положении. После застывания агара чашки с посевами помещают в термостат в перевёрнутом виде (крышкой вниз) при температуре 37 °С на 24 ч. После инкубации подсчитывают выросшие колонии и проводят пересчёт на 1 г почвы.
3. Определение бактерий группы кишечных палочек
3.1. Бродильный (титрационный) метод При анализе почвы с невысокой степенью фекального загрязнения рекомендуют проводить определение БГКП титрационным методом с использованием среды Кесслер или лактозного бульона с трифенилтетразолием хлорида (ТТХ). 10 см3 почвенной суспензии первого разведения (1:10) засевают во флакон с 50 см3 среды, что соответствует посеву 1 г почвы. Последующие разведения высевают по 1 см3 в пробирки с 9 см3 той же среды. Перед посевом в каждую пробирку с лактозным бульоном добавляют 0,3 см3 2% водного раствора ТТХ, а в каждый флакон – по 1,5 мл. Методика посева с использованием ТТХ основана на способности кишечной палочки восстанавливать бесцветное соединение ТТХ в трифенилформазан, выпадающий в осадок, придающий среде коричнево-красный цвет. Кишечная палочка устойчива к действию формазана, в то время как развитие другой микрофлоры подавляется. Посевы на среде Кесслер-Свенертона инкубируют 48 ч при температуре 43 или 37 °С. Отсутствие через 48 ч газообразования и помутнения в бродильных сосудах позволяет дать отрицательное заключение о наличии БГКП. Отрицательное заключение при использовании лактозного бульона с ТТХ дают через 24 ч в том случае, если в пробирках и флаконах цвет среды не изменился. При наличии признаков бактериального роста проводят высев на среду Эндо или розоловый агар. Чашки с посевами инкубируют при температуре 37 °С 24 ч. В случае отсутствия признаков роста на чашках дают отрицательное заключение. Красные, розовые с металлическим блеском, жёлтые и оранжевые колонии на розоловой среде типичны для кишечных палочек. На заключительном этапе исследования проводят идентификацию выросших на агаризованных средах характерных колоний (аналогично анализу БГКП в воде). Результаты анализа выражают коли-титром.
3.2. Метод мембранных фильтров Данный метод используют в качестве ускоренного метода анализа слабозагрязнённых почв. Через стерильные мембранные фильтры № 3 с помощью фильтровального аппарата Зейтца пропускают 5–10 см3 почвенной суспензии первого разведения, которую предварительно центрифугируют при 2000 об./мин в течение 5 мин. Дальнейшее исследование проводят аналогично анализу БГКП в воде методом мембранных фильтров. 3.3. Прямой поверхностный посев на плотные питательные среды
Этот метод применяют для исследования почвы из мест интенсивного фекального загрязнения. Проводят прямой поверхностный посев почвенной суспензии в количестве 0,1 или 0,05 см3на среды Эндо. При анализе сравнительно чистых почв посев проводят из разведений 1:10-1:100, для загрязнённых почв используют разведение 1:106. Посевы инкубируют в термостате при температуре 37 °С в течение 24 ч. На следующем этапе исследования идентифицируют выделенные бактерии (аналогично определению БГКП в воде). Результаты двух последних методов исследований выражают коли-титром или коли-индексом.
4. Определение перфрингенс-титра 4.1. Посев почвенных разведений в среду Вильсона-Блера
Из всех почвенных разведений (до 1:106) образцы по 1 см3 переносят в 2 параллельных ряда пробирок. Один ряд пробирок прогревают при температуре 80 °С в течение 15 мин и/или при 90 °С – 10 мин. Затем во все пробирки добавляют по 9-10 см3 свежеприготовленной среды Вильсона-Блера. Инкубацию посевов проводят при температуре 37 или 43 0С в течение 24 ч. Учёт можно проводить и несколько раньше, так как санитарно-показательные клостридии, преимущественно С. perfringens, через несколько часов образуют колонии чёрного цвета. Обнаружение в мазках колоний характерных грамположительных палочек указывает на наличие С. perfringens. Общепринятая методика определения С. perfringens на среде Вильсона-Блера имеет существенный недостаток – питательная среда в определённой степени ингибирует рост микроорганизма. Для устранения этого явления предложена модификация методики.
4.2. Использование сред накопления для определения клостридий в почве По 1 см3 прогретых и нативных почвенных разведений засевают в про-бирки с полужидкими и жидкими питательными средами, предварительно регенерированными кипячением (Клодницкого, Китт-Тароцци, бульона Мартена с ватой и др.). После инкубации посевов в течение 18-20 ч при температуре 37 °С проводят высев 0,5-1 см3 материала из помутневших пробирок в среду Вильсона-Блера или сульфит-полимиксин-неомициновую среду. Посев, инкубацию и учёт при этом проводят аналогично первому способу. 5. Определение термофильных бактерий
Учёт термофильных сапрофитных микроорганизмов производят на МПА, который разливают толстым слоем. Посев проводят из разведений 1:10-1:106 в 2-3 параллельные чашки Петри. Учёт проводят после инкубации в течение 24 ч при температуре 60 °С аналогично, как при определении общего количества бактерий в почве.
6. Определение нитрифицирующих бактерий
Для определения нитрифицирующих бактерий сеют почвенные разведения во флаконы с минеральной средой Виноградского, разлитой тонким слоем. В ходе эксперимента два флакона со средой оставляют незасеянными в качестве контроля чистоты среды. Посевы инкубируют при температуре 28 °С в течение 14-15 сут. При развитии нитрифицирующих бактерий в среде образуются азотистая и азотная кислоты, которые определяют на 5-7 сутки после посева и вторично – на 14-15. Титр нитрифицирующих бактерий определяют качественной реакцией с дифениламином, который в присутствии азотистой и азотной кислот даёт синее окрашивание. Пастеровской пипеткой несколько капель среды из каждого флакона, не взмучивая осадок, переносят на стеклянную или фарфоровую пластинку, добавляют несколько капель дефениламина, разведённого концентрированной серной кислоте. Синее окрашивание указывает на присутствие в среде продуктов метаболизма нитрифицирующих бактерий. Среда контрольных флаконов должна оставаться без изменения окраски.
Заключение _________________________________________________
Контрольные вопросы Как отбирают образцы почвы для исследований? Как формируется усредненная проба образцов почвы? Как определяется ОКБ в почве? Какие методы используются для определения БГКП в почве? В чем сущность бродильного метода определения БГКП? В каких случаях используется прямой поверхностный посев почвы на плотные питательные среды? Что такое перфрингенс-титр? Какими методами определяется перфрингенс-титр? Какие питательные среды используют для определения перфрингенс-титра? Какие среды накопления используют для определения клостридий в почве? Какие микроорганизмы называют термофильными? Каким образом определяют термофильные бактерии в почве? Какую питательную среду используют для определения нитрифицирующих бактерий? Какие СПМО почвы вы знаете? Какие микроорганизмы попадают в почву с выделениями человека и животных и дольше всех в ней сохраняются? Какие показатели определяют при санитарном анализе почвы? Какую роль в почве выполняют аммонификаторы и нитрификаторы?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №4 При выборе объектов в первую очередь обследуют почвы территорий, наиболее значимых для здоровья населения. При проведении текущего санитарного надзора за состоянием почвы ограничиваются кратким санитарно-микробиологическим анализом, указывающим на наличие и степень фекального загрязнения, а также характеризуют процессы самоочищения почвы от загрязнителей органической природы и энтеробактерий. Полный санитарно-микробиологический анализ почвы проводят в форме предупредительного санитарного надзора. Для изучения воздействия химических поллютантов на биогеоценоз необходимо исследование их бактерицидного действия на почвенную микробиоту, заключающегося в изменении состава сообщества почвенных микроорганизмов и ферментативной активности почвы. По эпидемическим показаниям проводят индикацию патогенной микробиоты. 1. Результаты исследования почвы используют для: · определения степени опасности для здоровья людей в населённых пунктах (по эпидемиологическим показаниям); · профилактики инфекционных и неинфекционных заболеваний (предупредительный санитарный надзор); · текущего санитарного контроля за объектами, прямо или косвенно воздействующими на окружающую среду.
2. Санитарно-показательные микроорганизмы, характеризующие загрязнение почвы Общее количество бактерий - количество микроорганизмов, образующих колонии на МПА при температуре 37 °С в течение 24 ч, - суммарный показатель микробиологического загрязнения почвы микрофлорой преимущественно фекального происхождения. Термофильные микроорганизмы - микроорганизмы, образующие колонии на МПА при температуре 60 °С в течение 24 ч, - показатель загрязнения почвы компостом или навозом. Почвы, показывающие высокое содержание кишечных палочек и низкое - термофилов, считают фекально загрязнёнными. БГКП- грамотрицательные не образующие спор короткие палочки, ферментирующие лактозу и глюкозу до кислоты и газа при температуре 37°С в течение 24-48 ч, не обладающие оксидазной активностью. Перфрингенс-титр - титр грамположительных облигатно-анаэробных спорообразующих палочек, восстанавливающих сульфиты. Присутствие Clostridium perfringens (споровых форм) свидетельствует о давнем фекальном загрязнении. Аммонификаторы - микроорганизмы, превращающие азот в катионы аммония. Аммонификация (гниение) белков - результат деятельности гнилостной микробиоты (актиномицеты, грибы, анаэробные бациллы). Высокое содержание в почве этой микробиоты свидетельствует о присутствии органических веществ. Нитрификаторы - микроорганизмы, окисляющие азот из солей аммония в нитраты и нитриты. К этой группе относятся представители родов Nitrosococcus, Nitrosolobus, Nitrosobacter. Их присутствие свидетельствует о наличии органического загрязнения и активно идущих процессах самоочищения. Аэробные целлюлозоразрушающие микроорганизмы - почвенная микробиота, использующая целлюлозу в качестве источника углерода. В этой группе велика роль неспоровых бактерий, базидиальных, дрожжеподобных и несовершенных грибов. Общая численность сапрофитов - количество микроорганизмов образующих колонии на МПА при температуре 28-30 °С в течение 72 ч. Высокая численность сапрофитной микробиоты свидетельствует об органическом загрязнении почвы. Патогенные микроорганизмы - сальмонеллы (Salmonella spp.), патогенные клостридии (С. tetani, С. botulinum), возбудитель сибирской язвы (Bacillus anthracis), вирусы.
3. Основные нормируемые микробиологические показатели почвы · ОМЧ · БГКП · Перфрингенс-титр · Определение термофильных бактерий · Аммонификаторы · Нитрификаторы · Аэробные целлюлозоразрушающие микроорганизмы · Общая численность сапрофитов · Патогенные микроорганизмы (сальмонеллы, C. tetani, C. botulinum, B. anthracis, вирусы)
4. Критерии оценки санитарного состояния почвы по микробиологическим показателям
Таблица 1. Характеристика загрязнения различных объектов внешней среды по санитарно-показательным микроорганизмам
Примечание: +++ очень много данного СПМО; ++ много СПМО; + присутствуют СПМО; - отсутствуют СПМО. З А Н Я Т И Е 5 Дата ______________ Тема: Санитарно-микробиологическое исследование воздуха.
План занятия: 1. Микробиологическое исследование воздуха, показания к проведению, объекты исследования, микробиологические показатели. 2. Санитарно-бактериологическое исследование воздуха: а) посев воздуха седиментационным методом Р. Коха; б) аспирационный метод.
Методические указания 1. Микробиологическое исследование воздуха, показания к проведению, объекты исследования, микробиологические показатели
Микробиологическое исследование воздуха проводится в плановом порядке (кратность определяется официальными документами) и по эпидемиологическим показаниям (при возникновении массовых инфекционных заболеваний). При плановых обследованиях проводят исследования только на СПМО, а при обследовании по эпидемиологическим показаниям – на патогенные и условно-патогенные микроорганизмы. Идентификация выделенных микроорганизмов осуществляется в соответствии с действующими нормативными документами. Исследованию подлежат следующие помещения ЛПУ: • операционные блоки, перевязочные и процедурные кабинеты, • асептические палаты (боксы), • палаты отделения анестезиологии и реанимации, • палаты и коридоры лечебных отделений, • помещения аптек, стерилизационных и акушерско-гинекологических отделений и • станций (отделений) переливания крови. Микробиологическое исследование воздуха предусматривает определение ОМЧ (общего микробного числа) и патогенных стафилококков (золотистый стафилококк) в 1 м3 воздуха при плановом контроле. В отдельных случаях дополнительно определяют наличие грамотрицательных бактерий, плесневых и дрожжевых грибов. При исследовании по эпидемиологическим показаниям спектр возбудителей существенно расширяется. Для определения ОМЧ воздуха и санитарно-показательных микроорганизмов (золотистого стафилококка) производят посев аспирационным и седиментационным методом.
2. Санитарно-бактериологическое исследование воздуха
а) посев воздуха седиментационным методом Р. Коха Седиментационный методКоха прост, не требует специальной аппаратуры. Суть метода: чашка с питательной средой ставится на рабочем столе, открывается на 10 мин, закрывается и ставится в термостат, где выдерживается двое суток при температуре 37 °С, а затем двое суток при комнатной температуре. После этого проводится подсчет выросших колоний по формуле Омелянского. Для выявления грибов в воздухе посев проводится на среду Сабуро, и чашка выдерживается при 22-25 °С до 5 суток. Для выявления патогенных бактерий посевы проводят на дифференциально-диагностические среды: для золотистого стафилококка – на желточно-солевой агар, для энтеробактерий – на среду Эндо с добавлением генцианвиолетта (для торможения роста сапрофитов), для псевдомонад – на среду № 9. Чашки выдерживают в открытом виде 1 час, после чего ставят в термостат для культивирования при 37 °С на двое суток с последующим выдерживанием при комнатной температуре в течение 2 суток. Расчет по модифицированной формуле Омелянского ведется на 1 м2 поверхности: X = n.104 / p.r2.t ,
где X - ОМЧ воздуха обследуемого помещения (КОЕ); п - количество колоний на чашке (КОЕ); t - время экспозиции чашки (мин); p.r2 - площадь чашки Петри (см2); 104 - пересчет м2 в см2.
Формула Омелянского, даже модифицированная, имеет ряд существенных недостатков: 1) нельзя определить точный объем воздуха, из которого микробы оседают на чашку; 2) мелкодисперсная фаза аэрозоля (а с ним и микробы) практически не оседает и токами воздуха постоянно поддерживается во взвешенном состоянии. Результаты, получаемые с помощью этого метода, позволяют сравнить, сопоставитьстепень микробной обсемененности разных помещений и ориентироваться при разработке мероприятий по очищению воздушной среды.
б) аспирационный метод
Аспирационный методизучения микрофлоры воздуха основан на использовании ударной струи воздуха, получаемый с помощью аппарата Кротова или других подобных ему аппаратов: (импактеры (ПУ-1Б), импинджеры (ПОВ-1), система HiAirPetriTM (последняя позволяет пропускать до 1000 л воздуха за 200 сек). Достоинства этого метода: - точно учитывается объем воздуха, пропускаемого через чашку с питательной средой, установленную в аппарате; - принцип ударной струи воздуха способствует фиксации на влажной поверхности питательной среде всех взвешенных частиц аэрозоля. Для определения санитарно-показательных микроорганизмов используют чашки с ЖСА, а для определения ОМЧ – МПА. Чашку с питательной средой помещают на вращающийся столик аппарата Кротова. Забирают 100л (ОМЧ) и 250л (СПМО) воздуха. Количество микроорганизмов определяют по формуле: V=v*t, где
V - объем забираемого воздуха; v - скорость просасывания воздуха - 25 л /мин; t - продолжительность забора воздуха - 10 минут.
Посевы инкубируют в течение 20-24 часов при температуре 37 °С, а затем их оставляют еще на 24-48 часов при комнатной температуре (ЖСА). Таким образом, удается фиксировать на поверхности плотной питательной среды максимальное количество микроорганизмов, обитающих в воздухе. Используя различные виды элективных и дифференциально-диагностических питательных сред, можно выявлять в воздухе все основные группы патогенных и условно-патогенных микроорганизмов.
Контрольные вопросы Какие помещения ЛПУ подлежат исследованию воздуха? Какие микробиологические показатели определяются при исследовании воздуха? Что такое резидентная микрофлора воздуха? Что такое транзиторная микрофлора воздуха? Какие санитарно-показательные микроорганизмами при исследовании воздуха в закрытых помещениях вы знаете? При каких заболеваниях воздух является основным фактором передачи? На каком принципе основан метод Коха при санитарно-микробиологическом исследовании воздуха? Какие недостатки имеет метод Коха? Как можно использовать результаты, полученные при исследовании воздуха методом Коха? В чем сущность аспирационного метода изучения микрофлоры воздуха? Какие приборы для отбора проб воздуха вы знаете? Какие достоинства имеет аспирационный метод исследования воздуха? Какая питательная среда используется для определения золотистого стафилококка? Что такое общая бактериальная обсемененность воздуха? ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №5
1. Понятия резидентной и транзиторной микрофлоры воздуха. Резидентная микрофлора – сапрофитные бактерии с липохромным пигментом (сарцины, микрококки, сапрофитный стафилококк и др.); бациллы (сенная палочка, микоидные бациллы и др.); плесневые, дрожжевые, дрожжеподобные грибы. Все эти микроорганизмы имеют структуры или механизмы, защищающие их от губительного действия ультрафиолетовых лучей, отсутствия влаги, питательных веществ. Транзиторная микрофлора – патогенные и условно-патогенные бактерии, вирусы. Они являются возбудителями воздушно-капельной инфекции, раневой инфекции, гнойно-воспалительных заболеваний и др. К ним относятся золотистый и эпидермальный стафилококк, дифтерийная, туберкулезная, синегнойная палочки, энтеробактерий (клебсиелла, протей, серрация и др.); вирусы кори, гриппа и др. В неочищенном воздухе во взвешенном состоянии находятся инородные включения различных размеров: · 0,03-0,30 мкм – вирусы, бактерии; · 10,0-100,0 мкм – частицы пыли; · 30,0-200 мкм – волокна, волосы. Бактерии находятся в воздухе в виде аэрозоля, который по размерам частиц делится на фазы: · крупнокапельная, быстро оседающая фаза – капли диаметром более 100 мкм; · мелкоядерная фаза – капли и частицы диаметром менее 10 мкм. Они длительно находятся во взвешенном состоянии, и часть из них испаряется раньше, чем оседает («бактериальная пыль»). Человек постоянно выделяет аэрозольные частицы, число которых колеблется от 1 тысячи до 30 миллионов в минуту, в зависимости от характера производимых им движений, состояния верхних дыхательных путей, интенсивности разговора. Капельки слюны, слизи при чихании, разговоре, кашле вместе с микробами попадают в воздух и с током воздуха могут разноситься далеко от источника. Бактерии могут оседать на пылевые частицы и «путешествовать» вместе с ними. Мелкодисперсные аэрозольные частицы практически не оседают и постоянно находятся во взвешенном состоянии. До 90% микробов, попадающих в воздух, погибают в течение 1 часа. З А Н Я Т И Е 6 Дата ______________ Тема: Санитарно-микробиологическое исследование мяса И мясных продуктов. План занятия: 1. Разбор основных правил отбора и пересылки проб мяса и мясных продуктов для исследования. 2. Проведение микроскопического исследование мяса путем определения 3. Микробиологическое исследование мяса и мясных продуктов на наличие санитарно-показательных и патогенных микроорганизмов. 3.1. Подготовка проб к исследованию. 3.2. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов. 3.3. Определение количества бактерий группы кишечных палочек. 3.4. Методы обнаружения сальмонелл. 3.5. Методы выявления и определения количества Staphylococcus aureusв колбасных изделиях и продуктах из мяса 3.6. Определение количества сульфитредуцирующих клостридий. 3.7. Методы выявления Listeria monocytogenes.
Методические указания 1. Разбор основных правил отбора и пересылки проб мяса и мясных продуктов для исследования
Для проведения микробиологических исследований мяса с целью выделения и идентификации микроорганизмов отбирают: · мышечную ткань; · лимфатические узлы; · паренхиматозные органы. Для бактериологических исследований скоропортящихся мясных продуктов (студни, зельцы, ливерные колбасы, кровяные изделия, паштеты) пробы отбирают с помощью стерильного ножа или других стерильных инструментов. Из выбранных единиц продукции берут разовые пробы и из них составляют общую пробу, а именно: • от колбасных изделий - не менее двух разовых проб, ломтики по 15 см толщиной от края батона; • от сосисок и сарделек - из разных мест, не нарушая целостности единиц продукции; • от языков - с двух единиц продукции; • от продуктов из свинины, баранины, говядины и мяса других видов убойных животных и птиц - пробы по всей толщине, ломтики шириной не менее 10 см от двух единиц продукции; • от окороков - срез по всей толщине, отбирают образцы шириной не менее 10 см; • от изделий без оболочки (студней, паштетов и др.) - разовые пробы не менее, чем от трёх единиц изделий массой 200-250 г каждая. Отбор проводят стерильными приспособлениями в стерильную посуду с соблюдением правил асептики и антисептики. Образцы массой не менее 200 г упаковывают в пергамент, целлюлозную или пищевую полиэтиленовую плёнку и помещают в бумажный пакет. Затем пробы пломбируют и снабжают сопроводительной документацией, в которой указывают дату и время отбора пробы, номер и размер партии, номер образца, наименование и сорт продукта, объём необходимых исследований, должность и фамилию лица, проводившего отбор проб, и направившего должностного лица. Транспортируют образцы в кратчайший срок, при этом целесообразно использовать сумки-холодильники. К исследованиям приступают не позднее, чем через 4 ч. Если это невозможно, отмечают причину задержки, а пробы хранят до анализа при температуре +4 °С (замороженные продукты - не выше -2 °С).
2. Проведение микроскопического исследование мяса путем определения
Микроскопическое исследование мяса основано на определении
3. Микробиологическое исследование мяса и мясных продуктов на наличие санитарно-показательных и патогенных микроорганизмов 3.1. Подготовка проб к исследованию Каждый образец (мышцы, лимфатические узлы, паренхиматозные органы) перед посевом освобождают от видимой жировой и соединительной ткани, погружают на 2-3 мин в этиловый спирт-ректификат и два раза обжигают с поверхности. Затем стерильными ножницами из каждого образца (с различной глубины) вырезают кусочки размерами 2,0 х1,5м2, 5 см. Лимфатические узлы разрезают пополам. Все вырезанные кусочки измельчают стерильными ножницами. Для последующих исследований готовят две пробы по 15 г каждая. Одна проба состоит из кусочков мышц и лимфатических узлов, а вторая - из кусочков паренхиматозных органов (печени, почек, селезёнки). Каждую пробу помещают в стерильный стакан (колбу) гомогенизатора, добавляют по 1,5 см3 0,9% раствора натрия хлорида и готовят взвеси в течение 2-5 мин. Полученные взвеси отстаивают 10 мин, и для исследований берут надосадочную жидкость. При бактериологическом исследовании мясных продуктов в лаборатории из каждой общей пробы готовят средние образцы массой примерно 20 г. Навески помещают в стерильные стаканы (колбы), добавляют 0,9% раствор натрия хлорида и гомогенизируют не более 2,5 мин. При отсутствии гомогенизатора допустимо приготовление взвеси растиранием 20 г продукта в стерильной фарфоровой ступке с 2-3 стерильного кварцевого песка, постепенно приливая 80 см3 стерильного 0,9% раствора натрия хлорида или стерильной воды. Приготовленные взвеси отстаивают в течение 15 мин и для дальнейших исследований берут надосадочную жидкость, 1 см3 которой содержит 4,2 г продукта.
3.2. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
Количество МАМ и ФАнМ в 1 г (см3) продукта определяют по числу колоний мезофильных аэробных и факультативно-анаэробных микроорганизмов, выросших на поверхности и в глубине плотных питательных сред при температуре 30±1 °С в течение 72 ч. Для определения количества микроорганизмов в стерильные чашки Петри вносят по 1 см3 разных разведений из каждой пробы, заливая их 10-15 см3 расплавленного и охлаждённого до температуры 45 °С агара. Разведения выбирают в соответствии со стандартом (техническими условиями) на данный продукт. Для подсчёта колоний используют лупу с 4-10-кратным увеличением или счётчик колоний. Для удобства каждую подсчитанную колонию отмечают со стороны дна маркером по стеклу. При значительном росте микробов дно чашки делят карандашом на секторы, подсчитывая число колоний отдельно в каждом секторе, а затем полученные числа складывают и умножают на степень разведения. Количество микроорганизмов (N) в 1 г (см3) пробы вычисляют, как средневзвешенное значение из подсчётов на двух последовательных разведениях по формуле: N=ΣC/V×(n1+0,1n2)×d,
где ΣС - сумма колоний, подсчитанных на всех чашках в двух последовательных разведениях, из которых хотя бы одна чашка содержит не менее 15 колоний; V- объём посевного материала, внесённого в каждую чашку, см3; n1 - количество отобранных для подсчёта чашек в первом разведении; n2 - количество отобранных для подсчёта чашек во втором разведении; d- коэффициент разбавления, соответствующий первому разведению.
Результат вычисления округляют до двух значащих цифр. Для получения достоверных результатов при подсчёте необходимо, чтобы хотя бы в одной чашке содержалось не менее 15 колоний. В противном случае указывают приближённое количество микроорганизмов в 1 см3, рассчитанное по среднему арифметическому колоний, выросших на двух чашках.
3.3. Определение количества бактерий группы кишечных палочек
Навеску анализируемого продукта (1,0-0,001 г по СанПиН 2.3.2.1078-01), в которой не должно быть БГКП, смешивают с 9 частями жидкой питательной среды (чаще всего используют среду Кесслер, содержащую в своём составе генцианвиолет, угнетающий рост грамположительных бактерий). Из пробирок с забродившей средой (помутнение, наличие газа в поплавках) делают посевы на чашки со средой Эндо. Посевы выдерживают в термостате при температуре 37 °С в течение 18-24 ч. Из колоний, типичных для БГКП (красных, с металлическим блеском, розовых, бледно-розовых), готовят мазки и окрашивают их по Граму.
3.4. Методы обнаружения сальмонелл
Пробу мяса или мясного продукта дважды пропускают через мясорубку, перемешивают, взвешивают 25 г, затем помещают в стерильную банку смесителя с 225 см3 буферной пептонной водой и гомогенизируют. Далее в асептических условиях переносят содержимое смесительной банки в стерильную колбу вместимостью 500 см3. Колбу выдерживают в термостате при температуре (37±1) °С не менее 16 и не более 20 ч, после чего приступают к анализу. Выявление сальмонелл проводится в четыре последовательных этапа: первичный (прямой) посев, обогащение, посев со среды обогащения и подтверждение. Первичный посев производится путем посева взвеси исследуемого материала на плотные элективные среды. Эти среды выдерживают в термостате при температуре 37 °С и исследуют на присутствие колоний, которые являются типичными или подозрительными на сальмонеллы. На элективных средах сальмонеллы растут, образуя характерные колонии: - на фуксин-сульфитном агаре (агаре Эндо) сальмонеллы растут в виде круглых, бесцветных или слегка розоватых прозрачных, или полупрозрачных колоний; - на эозин-метиленовом синем агаре (агаре Левина) сальмонеллы растут в виде прозрачных, бледных, нежно-розовых или розовато-фиолетовых колоний. Обогащение проводят путем посева на жидкие селективные среды (среды Мюллера, Кауфмана и Киллиана, селенитовый Ф-бульона и хлористо-магниевая среды "М"). Эти среды выдерживают в термостате при температуре 37 °С. На селенитовом бульоне лучшей температурой для накопления сальмонелл является 43 °С. В случае отсутствия роста бактерий сальмонелл при первичном (прямом) посеве на элективных средах, через 12-24 ч проводят высев на селективные среды со сред обогащения. Предварительно содержимое флаконов перед пересевом тщательно перемешивают и высевают штрихом петлей диаметром 2,5-3 мм на чашку с висмут-сульфитным агаром, бактоагаром Плоскирева или агаром Эндо. Посевы помещают в термостат на 18-24 ч при температуре 37 °С, а посевы на висмут-сульфитном агаре - на 48 ч. На селективных средах сальмонеллы растут, образуя характерные колонии: - на бактоагаре Плоскирева сальмонеллы растут в виде бесцветных колоний, но колонии более плотные и несколько меньшего размера, чем на среде Эндо; - на висмут-сульфитном агаре сальмонеллы растут в виде черных или коричневых колоний с характерным металлическим блеском. Далее проводят подтверждение - пересев подозрительных на сальмонеллы колоний и определение их биохимических и серологических характеристик. В соответствии с нормативами санитарно-биологических показателей для мяса и мясных продуктов содержание сальмонелл в 25 г исследованного продукта не допустимо.
3.5. Методы выявления и определения количества Staphylococcus aureus в колбасных изделиях и продуктах из мяса
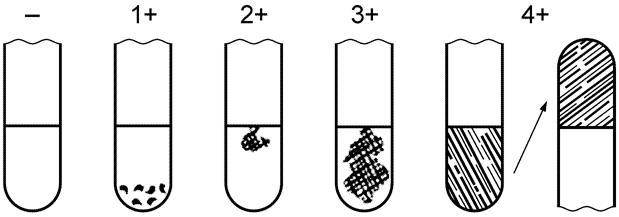
Сущность метода заключается в определении морфологии, характера роста на питательных средах и в способности отдельных стафилококков продуцировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы. Методика проведения анализа заключается в следующем. Из разведения анализируемой взвеси продукта (1:10) проводят посевы на молочно-солевой агар, содержащий 65 г/дм3 хлористого натрия, для выявления пигмента или желточно-солевой агар, содержащий 65 г/дм3 хлористого натрия, для выявления лецитиназной активности. Взвесь наносят на поверхность агара в количестве 0,2 см3 и равномерно растирают по всей поверхности агаровой среды. Посевы термостатируют в течение 24 ч при температуре 37 °С и 24 ч выдерживают при комнатной температуре. На поверхности питательной среды колонии стафилококка имеют вид плоских или слегка выпуклых блестящих колоний с ровным краем. При этом на молочно-солевом агаре лучше выявляется пигмент (эмалево-белый или золотистый), а на желточно-солевом агаре колонии стафилококков могут образовывать «радужный венчик», что является одним из признаков их патогенности. Из подозрительных колоний готовят препараты, которые окрашивают по Граму. При наличии стафилококков в препарате обнаруживаются грамположительные мелкие кокки, располагающиеся неправильными гроздьями. Для подтверждения признаков патогенности стафилококков ставят реакцию плазмокоагуляции. В прибор с 0,5 см3 цитратной плазмы крови кролика, разведенной физиологическим раствором в соотношении 1:4, вносят петлю чистой суточной культуры стафилококка и ставят в термостат при температуре 37 °С. Реакцию плазмокоагуляции учитывают через 3-4 ч (не встряхивая пробирку) и оставляют в термостате на сутки для окончательного учета через 24 ч. Тест на коагулазу считают положительным, если культура показала, по крайней мере, 3+ - оценку коагулазной реакции, отмеченной на рисунке 1. Реакцию на 1+ или 2+ оценивают как промежуточную.
Рис. 1. Результаты коагулазного теста
- отрицательная оценка: не отмечено образования фибрина; 1+ положительная оценка: небольшие несформировавшиеся комочки; 2+ положительная оценка: небольшой сформировавшийся комок; |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 468. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||